Cellekommunikasjon
For at kroppen skal fungere som en koordinert helhet, må cellene våre kunne kommunisere med hverandre. Hver celle inngår i et dynamisk nettverk av signaler og responser som styrer vekst, utvikling, differensiering, metabolisme og overlevelse. Uten denne kommunikasjonen ville celler mistet evnen til å tilpasse seg miljøet, samarbeide med naboceller eller opprettholde kroppsfunksjoner.
Cellekommunikasjon er derfor helt grunnleggende for livet, enten det dreier seg om å få hjertet til å slå, et sår til å gro, eller en immunrespons til å aktiveres mot en infeksjon. Ingen normale celler kan overleve uten signaler fra omgivelsene sine.
I multicellulære organismer skjer denne kommunikasjonen ved at en celle sender et signal, og en annen celle mottar og responderer på dette signalet. Signalene kan være av mange ulike typer – fra små molekyler og gasser til komplekse proteiner – men felles for dem alle er at de må binde seg til spesifikke reseptorer for å utløse en respons.
Et viktig prinsipp er at cellens respons avhenger både av hvilken type signal den mottar, og av hvilke reseptorer og intracellulære signalveier cellen uttrykker. To ulike celletyper kan dermed reagere helt forskjellig på det samme signalet, alt etter hvilken «mottaksstasjon» de har innebygd.
Cellekommunikasjon kan skje raskt eller langsomt. Noen ganger skjer responsen i løpet av sekunder – som når nervesystemet aktiverer en muskel for å trekke seg sammen. Andre ganger tar det timer eller dager, fordi cellen må endre hvilke proteiner den lager, slik vi ser under langvarig betennelse eller vevsombygging.
Fem hovedtyper av cellekommunikasjon
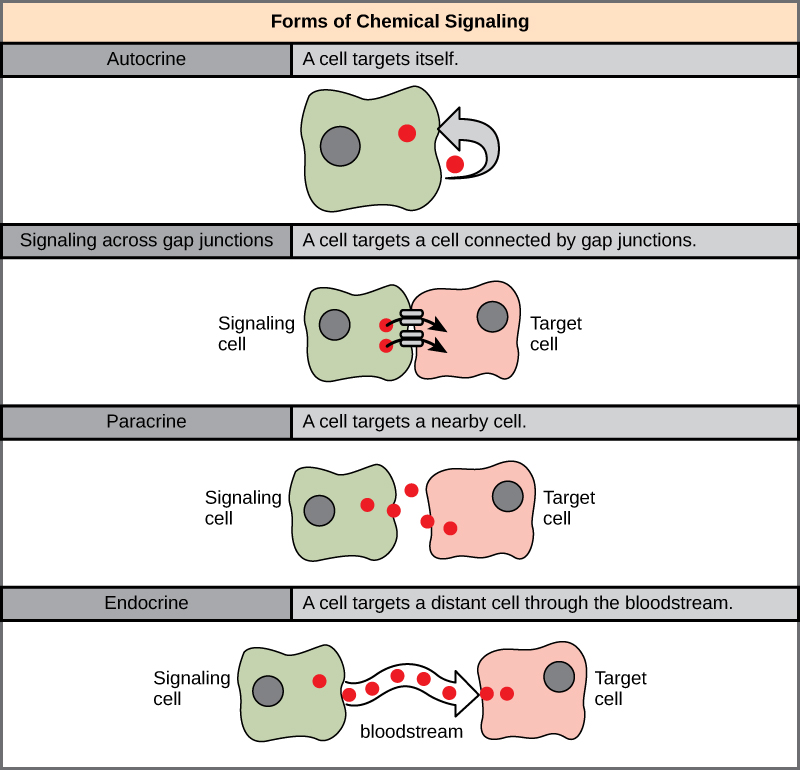
For å forstå hvordan celler kommuniserer, må vi først se på de ulike måtene signaler kan sendes på. Avstanden mellom sender- og mottakercellen, og typen signalmolekyl som brukes, bestemmer hvilken kommunikasjonsform som benyttes. I hovedsak finnes det fem måter celler kan sende signaler på:
1. Endokrin signalering
Ved endokrin signalering sendes signalmolekyler, kalt hormoner, ut i blodbanen. Hormoner kan reise lange avstander gjennom kroppen og påvirke celler langt unna der de ble produsert. Fordi hormoner transporteres via blodet, tar det litt tid før de når frem til målcellen. Men samtidig kan ett hormon nå mange ulike celler samtidig.
Et eksempel på endokrin signalering er insulin, som slippes ut fra bukspyttkjertelen etter et måltid og reiser med blodet for å regulere sukkeropptaket i lever, muskler og fettvev.
2. Parakrin signalering
Parakrin signalering skjer lokalt. Her slippes signalmolekyler ut i vevsvæsken og påvirker nærliggende celler uten å gå via blodbanen. Slik kan en celle raskt koordinere aktiviteten til naboene sine.
Et klassisk eksempel på parakrin signalering er betennelsesprosessen, der immunceller frigjør signalmolekyler som rekrutterer og aktiverer andre immunceller i nærheten.
3. Autokrin signalering
Ved autokrin signalering virker cellen på seg selv. Den produserer et signalmolekyl som binder seg til sine egne reseptorer og påvirker sin egen aktivitet. Dette kan være en måte for cellen å forsterke sitt eget signal på, eller å regulere seg selv i respons på endringer i omgivelsene.
Eksempelvis kan T-celler i immunsystemet frigjøre signalmolekyler som stimulerer deres egen vekst og deling under en immunrespons.
4. Synaptisk (nevronal) signalering
I nervesystemet kommuniserer celler på en helt spesiell måte: via elektriske impulser langs nerveutløpere (aksoner) og ved hjelp av nevrotransmittere som frisettes over små spalter mellom nerveceller, kalt synapser.
Synaptisk signalering er ekstremt rask, og gjør det mulig å sende presise, målrettede signaler på brøkdelen av et sekund – for eksempel når du trekker hånden vekk fra en varm plate.
5. Kontaktavhengig signalering (juxtakrin signalering)
Ved kontaktavhengig signalering må cellene være i direkte fysisk kontakt. Her er både signalmolekyl og reseptor festet til celleoverflaten, og signalet overføres først når cellene berører hverandre. Denne formen for kommunikasjon er viktig under fosterutvikling, i immunsystemet, og når celler i vev koordinerer vekst og differensiering.
Ligander og reseptorer
For at en celle skal kunne motta et signal, må den ha en måte å gjenkjenne signalmolekylet på. Dette skjer gjennom spesifikke proteiner kalt reseptorer, som finnes enten på celleoverflaten eller inne i cellen.
Selve signalmolekylet som binder seg til en reseptor, kalles en ligand. En ligand kan være et lite molekyl, som en gass eller en nukleotid, eller det kan være et større molekyl som et protein eller et peptid. Felles for alle ligander er at de må passe perfekt til reseptoren sin – omtrent som en nøkkel i en lås.
Når en ligand binder seg til reseptoren, fører dette til en konformasjonsendring (en strukturell endring) i reseptoren. Denne endringen utløser igjen en rekke intracellulære prosesser som til slutt fører til en spesifikk respons i cellen.
Viktige trekk ved ligand-reseptor-interaksjoner:
- Spesifisitet: Hver reseptor gjenkjenner kun bestemte ligander.
- Høy affinitet: Ligander binder seg med høy presisjon, selv når de finnes i svært lave konsentrasjoner.
- Respons: Bindingen utløser en reaksjon – enten umiddelbart (rask respons) eller over tid (langsommere respons).
Et viktig prinsipp er at en celle bare kan svare på et signal hvis den uttrykker den aktuelle reseptoren. Uten reseptoren forblir cellen «blind» for signalet, selv om signalmolekylet er til stede.
I tillegg kan samme ligand gi ulike responser i forskjellige celler, avhengig av hvilke reseptorer og intracellulære signalveier som aktiveres. For eksempel kan acetylkolin få hjertet til å slå saktere, få spyttkjertler til å skille ut væske, eller få skjelettmuskulatur til å trekke seg sammen – alt etter hvilken celle som mottar signalet.
Reseptorer – Celleoverflate og intracellulære reseptorer
For at en celle skal kunne motta og svare på signaler fra omgivelsene, må den uttrykke spesifikke proteiner kalt reseptorer. Reseptorene fungerer som cellens «antenner», og sørger for at signalmolekyler (ligander) kan fanges opp og oversettes til en tilpasset respons inne i cellen. Hvor reseptoren befinner seg – på celleoverflaten eller inne i cellen – avhenger av hva slags signalmolekyl som skal mottas.
Vi skiller derfor mellom to hovedtyper av reseptorer: celleoverflatereseptorer og intracellulære reseptorer.
Celleoverflatereseptorer
De fleste signalmolekyler er enten for store, for vannløselige eller for ladede til å kunne krysse den hydrofobe plasmamembranen. For slike signaler må reseptoren være plassert på celleoverflaten. Her fungerer celleoverflatereseptorer som mottakere som overfører signalet fra utsiden av cellen til innsiden.
Når et signalmolekyl binder seg til en slik reseptor, fører det til en konformasjonsendring i reseptoren, som igjen starter en intracellulær signalvei. Denne kjedereaksjonen kan enten føre til en rask endring i funksjonen til eksisterende proteiner inne i cellen, eller til aktivering av transkripsjonsfaktorer som på sikt påvirker hvilke gener som uttrykkes.
Eksempler på celleoverflatereseptorer inkluderer G-protein-koblede reseptorer (GPCR), ligandstyrte ionekanaler, og enzymkoblede reseptorer som reseptor-tyrosinkinaser (RTK).
En typisk egenskap ved celleoverflatereseptorer er at de muliggjør svært raske cellulære responser, noen ganger i løpet av sekunder. Dette skyldes at de ofte aktiverer proteiner og enzymer som allerede finnes inne i cellen, klare til bruk.
Intracellulære reseptorer
Noen signalmolekyler er derimot små og hydrofobe nok til å passere direkte gjennom plasmamembranen. Disse molekylene, som ofte er steroidhormoner, tyroidhormoner eller små gasser som nitrogenoksid (NO), binder seg til reseptorer inne i cellen – enten i cytoplasma eller i cellekjernen.

Når et slikt signalmolekyl kommer inn i cellen og binder seg til sin intracellulære reseptor, dannes et aktivt ligand-reseptor-kompleks. Dette komplekset vandrer ofte videre inn i kjernen, hvor det fungerer som en transkripsjonsfaktor og regulerer uttrykket av spesifikke gener. Endringen i genuttrykk resulterer etter hvert i syntese av nye proteiner, som gir mer varige endringer i cellens funksjon.
Eksempler på intracellulære reseptorer er reseptorene for kortisol, østrogen, vitamin D, og tyroksin.
Responsen via intracellulære reseptorer er som regel langsommere enn ved celleoverflatereseptorer, fordi prosessen involverer transkripsjon av nye gener og påfølgende proteinsyntese. Til gjengjeld er effekten ofte mer stabil og langvarig.
Kort oppsummert i én setning:
Celleoverflatereseptorer gir raske responser ved å aktivere eksisterende proteiner, mens intracellulære reseptorer gir langsommere, men varige endringer ved å regulere genuttrykk.
Ulike responser på samme signalmolekyl
Et fascinerende trekk ved cellekommunikasjon er at samme signalmolekyl kan gi helt ulike responser avhengig av hvilken celletype det påvirker. Dette skyldes både ulik type reseptor cellen uttrykker, og ulike intracellulære signalveier som aktiveres.
Selv om et signalmolekyl binder seg til en reseptor, er det ikke bare reseptoren som bestemmer responsen. Hele det intracellulære «maskineriet» som kobler reseptoraktivering til cellens atferd, spiller en avgjørende rolle. Dermed kan en og samme ligand gi alt fra aktivering, hemming, sekresjon eller kontraksjon – alt avhengig av hvem som mottar signalet.
Eksempel: Acetylkolin
Et klassisk eksempel er signalmolekylet acetylkolin, som kan gi tre helt forskjellige responser i tre ulike celletyper:
- I hjertemuskelceller (pacemakerceller) fører acetylkolin til redusert hjertefrekvens. Her binder acetylkolin til en spesifikk type reseptor som, via G-proteiner, aktiverer kaliumkanaler og hyperpolariserer cellen, noe som gjør den tregere til å fyre aksjonspotensialer.
- I skjelettmuskelceller fører acetylkolin til muskelkontraksjon. I dette tilfellet binder acetylkolin seg til nikotinerge ionekanalkoblede reseptorer på muskelcellen, noe som raskt depolariserer membranen og utløser en kontraksjon.
- I spyttkjertelceller stimulerer acetylkolin sekresjon av spytt. Her aktiverer acetylkolin G-protein-koblede reseptorer som øker intracellulær kalsiumkonsentrasjon, noe som igjen stimulerer eksocytose av spyttvesikler.
Forstå dette! Det er kjempeviktig i forhold til signalveier og responser i hjertet, bronkiolene og blodårer. Forstår man grunnlaget nå, så blir det ikke så vanskelig senere.
Hvorfor blir svaret så forskjellig?
Grunnen til at samme molekyl gir så ulike responser er todelt:
- Ulike reseptortyper: Celler kan uttrykke ulike typer reseptorer som binder samme ligand, men kobler til helt forskjellige signalveier inne i cellen.
- Ulike intracellulære signalveier og maskineri: Selv om reseptoren er lik, kan signalet kobles til ulike proteiner og prosesser inne i cellen, avhengig av hva slags maskineri cellen har tilgjengelig.
Dette betyr at cellene tilpasser sin respons basert på både hvilken reseptor de uttrykker og hvilke interne signaleringsnettverk de er koblet til. Summen av dette bestemmer utfallet.
Enkelt oppsummert:
Samme signal kan føre til helt ulike reaksjoner fordi forskjellige celler uttrykker ulike reseptorer og har ulikt intracellulært signalutstyr.
Summen av signaler avgjør cellens skjebne
En celle befinner seg aldri i et vakuum. Hele tiden mottar den flere signaler samtidig fra sine omgivelser – signaler som kan være vekststimulerende, hemmende, differensierende eller programmerende for celledød. Hvordan cellen til slutt reagerer, avhenger ikke av ett enkelt signal alene, men av summen av alle signalene den mottar og hvordan den integrerer dem.
Denne integrasjonen av signaler fungerer nesten som et komplekst regnestykke: signalene vektes, sammenstilles og tolkes, og først deretter bestemmer cellen sin atferd.
Mulige utfall for en celle
Basert på hvilke signaler den mottar – og i hvilken styrke – kan en celle ta flere forskjellige valg:
- Overlevelse:
Dersom cellen mottar nødvendige signaler for overlevelse, som trofiske faktorer, vil den fortsette å leve uten nødvendigvis å endre seg vesentlig. - Vekst og deling:
Signalering fra vekstfaktorer som aktiverer veier som PI3K-Akt og MAPK-kaskader, kan få cellen til å gå inn i celledeling og øke sin størrelse og antall. - Differensiering:
Spesifikke signaler kan få en stamcelle til å differensiere til en mer spesialisert celletype, for eksempel en muskelcelle, en nervecelle eller en epitelcelle. - Apoptose (programmert celledød):
Hvis overlevelsessignalene uteblir, eller hvis cellen mottar sterke døds-signaler, kan den aktivere et internt selvmordsprogram kalt apoptose. Dette er en ryddig og kontrollert måte å fjerne celler som ikke lenger er ønsket.
Viktige prinsipper i signalintegrasjon
- Signalprioritering:
Noen signalveier har forrang over andre. For eksempel vil sterke apoptosesignaler kunne overstyre svake vekstsignaler. - Avhengighet av kombinasjoner:
Mange celler krever en kombinasjon av signaler for å få en bestemt respons. Et vekstsignal alene kan være utilstrekkelig uten samtidig tilstedeværelse av et overlevelsessignal. - Timing og varighet:
Hvor lenge et signal er aktivt kan også påvirke cellens respons. Kortvarig aktivering kan gi en annen effekt enn langvarig aktivering av samme signalvei.
Informasjonsoverføring – fra ligandbinding til cellulær respons
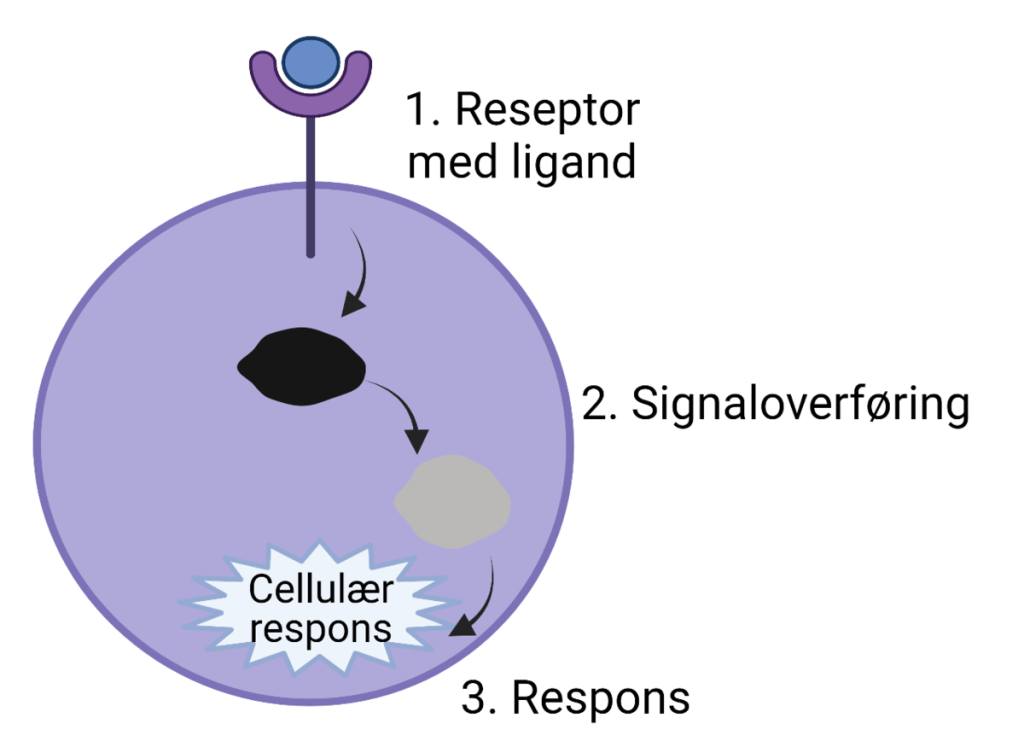
Når en celle skal svare på et signal fra omgivelsene, starter prosessen alltid med at et signalmolekyl, kalt en ligand, binder seg til en spesifikk reseptor på cellens overflate eller inne i cellen. Denne bindingen er svært spesifikk og skjer med høy affinitet. Når liganden fester seg til reseptoren, utløses en konformasjonsendring i reseptorproteinet – det vil si at proteinet endrer form på en måte som aktiverer det.
Denne aktiveringen av reseptoren setter i gang en intracellulær signalvei. Avhengig av reseptortype kan dette innebære aktivering av G-proteiner, ionekanaler, enzymer eller andre signalformidlere inne i cellen. Signalet forsterkes ofte underveis gjennom en kaskadereaksjon, slik at én enkelt ligandbinding kan føre til aktivering av mange intracellulære molekyler.
Til slutt fører denne signalkjeden til en cellulær respons. Responsen kan være rask eller langsom, midlertidig eller varig, avhengig av hvilken signalvei som aktiveres og hvilken type celle som mottar signalet.
Oppsummert følger prosessen disse trinnene:
- Ligand binder seg til reseptor
- Reseptoren endrer form (konformasjonsendring)
- Intracellulær signalvei aktiveres
- Cellulær respons utløses
Denne grunnleggende mekanismen er felles for nesten all cellekommunikasjon i kroppen.
Rask og langsom cellekommunikasjon
Et signal fra en ligand kan føre til svært forskjellige responser i en celle, avhengig av hvilken type intracellulær prosess som aktiveres. Grovt sett deler vi responsene inn i rask og langsom cellekommunikasjon.
Rask respons
En rask cellulær respons skjer i løpet av sekunder til minutter. Her påvirker signalet eksisterende proteiner direkte – for eksempel ved å endre funksjonen til ionekanaler, transportproteiner, enzymer eller cytoskjelettkomponenter. Denne typen respons krever ikke at nye proteiner produseres; cellen bruker i stedet proteiner som allerede er på plass.
Eksempel på rask respons:
- Når adrenalin binder seg til en β₂-adrenerg reseptor i en muskelcelle, aktiveres intracellulære signalveier som raskt øker glykogen-nedbrytning, slik at muskelcellen får tilgang til mer energi.
Langsom respons
En langsom cellulær respons utvikler seg over minutter til timer, og innebærer endring i genuttrykk. Her aktiveres signalveier som til slutt påvirker transkripsjonen av spesifikke gener i cellekjernen. Resultatet blir syntese av nye proteiner som gir varige endringer i cellens funksjon.
Eksempel på langsom respons:
- Når angiotensin II stimulerer glatte muskelceller i blodkar, fører dette ikke bare til rask vasokonstriksjon, men fører, over tid og ved høye doser, også til langsiktig cellevekst og hypertrofi. Dette skjer ved at signalet beveger seg inn i cellekjernen og aktiverer genprogrammer som koder for proteiner som øker cellevolumet og fremmer fibrose.
Tre hovedklasser av celleoverflatereseptorer
Celleoverflatereseptorer er spesialiserte proteiner som registrerer signalmolekyler utenfra og oversetter dem til intracellulære responser. Selv om det finnes mange ulike reseptorer, kan de fleste deles inn i tre hovedklasser, basert på hvordan de formidler signalet inn i cellen.
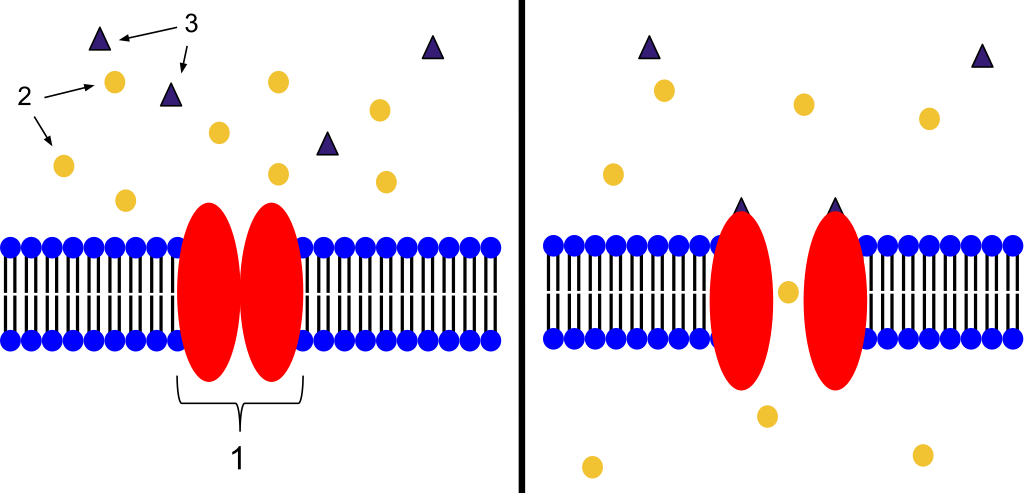
Ligandstyrte ionekanaler
Ligandstyrte ionekanaler fungerer som porter som åpnes når et spesifikt signalmolekyl binder seg til reseptoren. Når kanalen åpnes, strømmer ioner som natrium (Na⁺), kalium (K⁺) eller kalsium (Ca²⁺) raskt inn eller ut av cellen. Dette endrer cellens elektriske ladning og kan utløse raske, elektriske responser.
Eksempel:
- Nikotinerge acetylkolinreseptorer i nevromuskulære synapser er ligandstyrte ionekanaler. Når acetylkolin binder seg, åpnes kanalen for natriumioner, noe som raskt depolariserer muskelcellen og fører til kontraksjon.
Denne mekanismen er spesielt viktig i nervesystemet og i muskelaktivitet, hvor rask overføring av signaler er nødvendig.
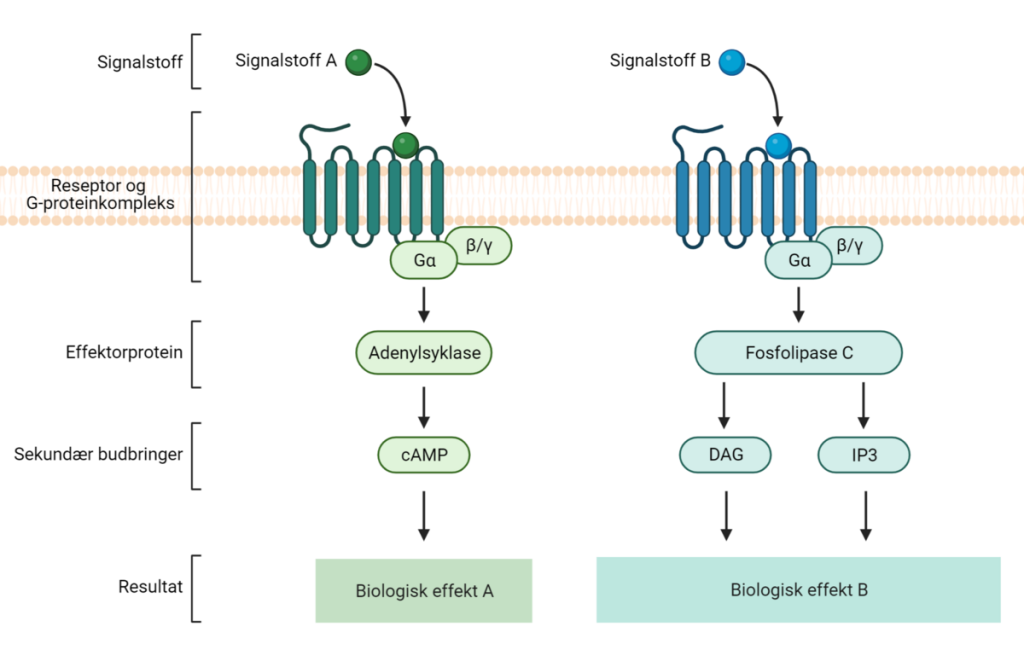
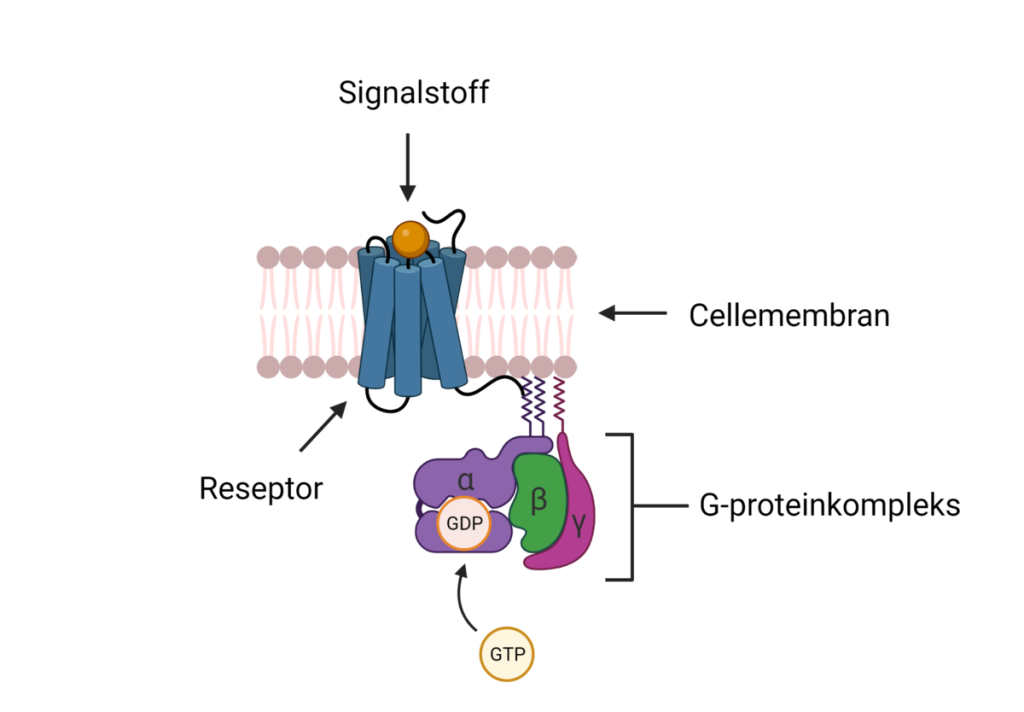
G-protein-koblede reseptorer (GPCR)
G-protein-koblede reseptorer er en svært stor og mangfoldig gruppe reseptorer som, når de aktiveres av en ligand, påvirker intracellulære signalveier via G-proteiner. Disse reseptorene kan enten stimulere eller hemme produksjonen av sekundære budbringere som for eksempel cAMP eller IP₃/DAG, som videre setter i gang forskjellige kaskadereaksjoner i cellen.
Eksempler:
- Adrenalin binder seg til β-adrenerge reseptorer (en type GPCR) og aktiverer produksjonen av cAMP.
- Acetylkolin kan også virke på muskarinerge reseptorer (en annen type GPCR) i det autonome nervesystemet.
GPCR-systemet gir cellen stor fleksibilitet og kontroll over mange fysiologiske prosesser, inkludert metabolisme, sekresjon, muskeltonus og sanseopplevelser.
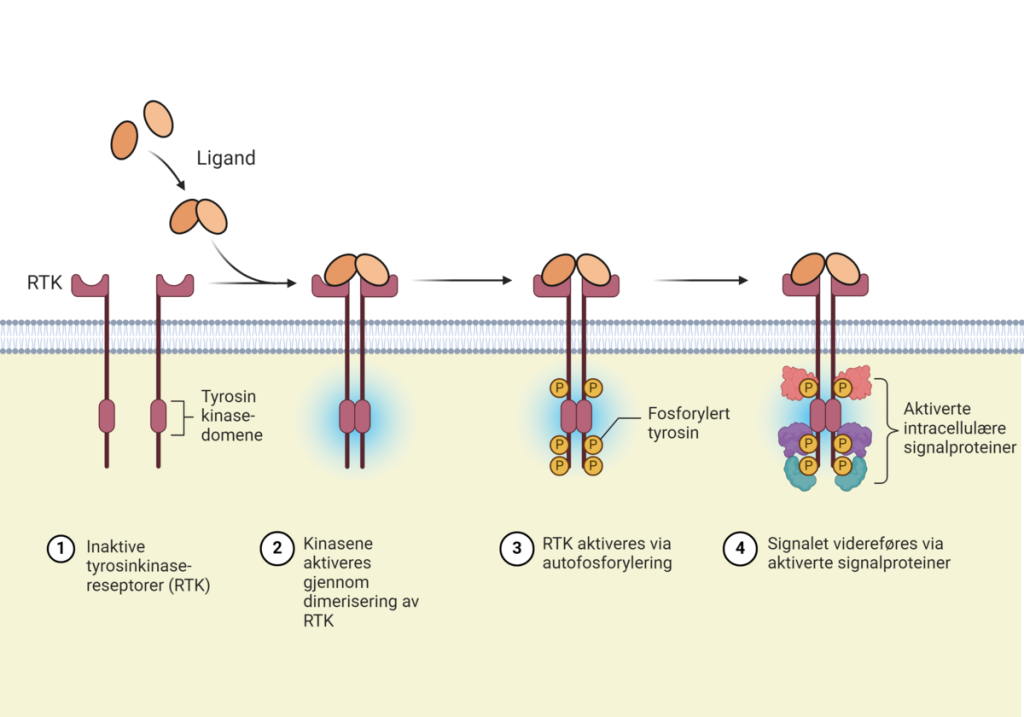
Enzymkoblede reseptorer
Enzymkoblede reseptorer har, som navnet antyder, en enzymaktivitet knyttet til seg. Når en ligand binder seg, dimeriserer ofte to reseptorer og aktiverer en intracellulær enzymfunksjon, som for eksempel en tyrosinkinase. Dette fører til fosforylering av intracellulære proteiner, som igjen aktiverer nedstrøms signalveier.
Eksempel:
- Insulinreseptoren er en enzymkoblet reseptor som aktiverer en rekke intracellulære proteiner når insulin binder seg. Dette stimulerer blant annet glukoseopptak i cellene.
Enzymkoblede reseptorer er særlig viktige i reguleringen av cellevekst, differensiering, metabolisme og overlevelse.
Intracellulær signaloverføring
Når en ligand binder seg til en celleoverflatereseptor, er ikke oppgaven ferdig. Selve bindingen er bare starten på en serie av nøye koordinerte hendelser inne i cellen, som til sammen kalles intracellulær signaloverføring. Målet med signaloverføringen er å oversette det ytre signalet til en spesifikk, målrettet respons inne i cellen.
Fra reseptor til respons
Bindingen av en ligand til en reseptor fører ofte til en konformasjonsendring i reseptorproteinet. Denne endringen setter i gang en kaskade av signaler som kan involvere en rekke ulike molekyler inne i cellen. Disse signalene blir ofte forsterket gjennom hvert trinn i kaskaden, slik at en enkelt ligandbinding kan gi en kraftig cellulær effekt.
Avhengig av hvilken reseptortype som aktiveres, kan de intracellulære signalveiene involvere:
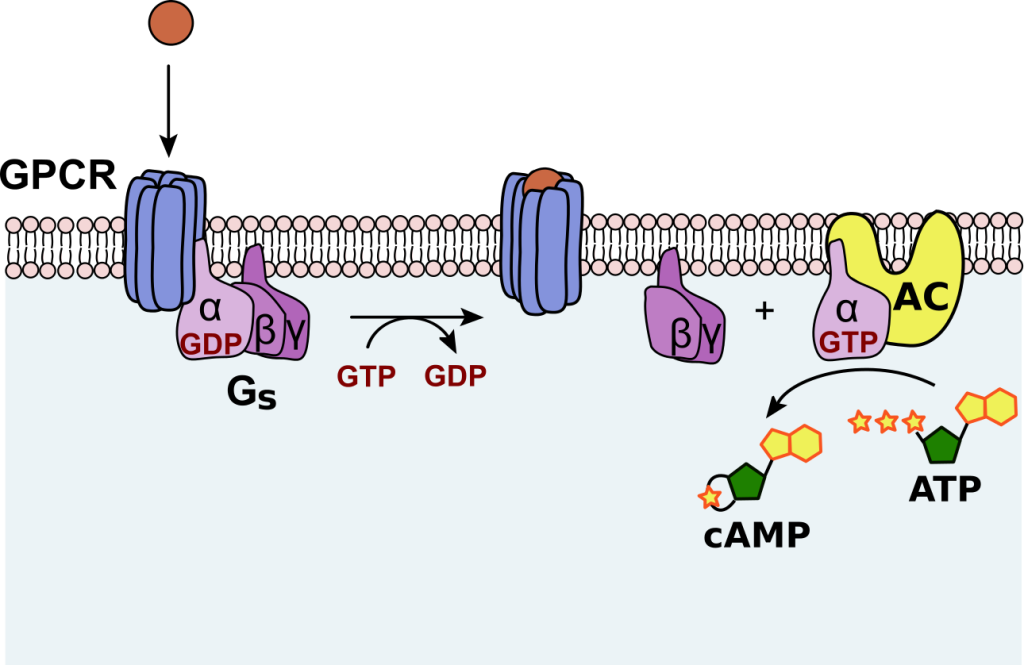
1. Aktivering og inaktivering av G-proteiner
For reseptorer som er koblet til G-proteiner (GPCR), vil ligandbinding føre til at G-proteinet aktiveres ved å bytte ut GDP med GTP på sin alfa-subenhet. Det aktiverte G-proteinet kan så påvirke ulike mål, som enzymer eller ionekanaler. Etter en kort stund vil G-proteinet hydrolysere GTP tilbake til GDP og dermed inaktivere seg selv, slik at signalet stoppes.
2. Produksjon av sekundære budbringere
Ofte vil signaloverføringen inne i cellen inkludere dannelse av sekundære budbringere – små molekyler som sprer signalet videre og aktiverer nye komponenter. Noen viktige sekundære budbringere inkluderer:
- cAMP (syklisk AMP), som aktiverer proteinet PKA og påvirker blant annet metabolismen i cellen.
- IP₃ (inositoltrifosfat), som frigjør kalsium fra intracellulære lagre.
- DAG (diacylglyserol), som sammen med kalsium aktiverer protein kinase C (PKC).
Ved hjelp av sekundære budbringere kan cellen raskt og effektivt forsterke og spre signalet fra reseptoren.
3. Fosforyleringskaskader
Et sentralt trekk ved mange signalveier er at de utløser fosforyleringskaskader. Dette innebærer at en serie av proteinkinaser aktiveres i rekkefølge ved å fosforylere hverandre, som dominobrikker som velter etter tur. Eksempler på slike kaskader inkluderer:
- MAPK-kaskaden, som ofte aktiveres av vekstfaktorer og fører til celleproliferasjon og genregulering.
- Akt/PI3K-signalveien, som fremmer celleoverlevelse og vekst ved å hemme apoptose og stimulere metabolisme.
Fosforylering fungerer som en bryter som slår proteiner «på» eller «av», og gir en rask, men kontrollerbar måte å regulere cellulære prosesser på.
Fosforylering som «brytere» i signaloverføring
Et helt sentralt prinsipp i intracellulær signalering er bruk av fosfatgrupper som «brytere» for å regulere proteiners aktivitet. Fosforylering fungerer som en rask og presis måte å kontrollere hvordan cellen responderer på signaler.
Hvordan virker fosforylering?
Fosforylering innebærer at en fosfatgruppe (PO₄³⁻) kobles på bestemte aminosyrer i et protein, vanligvis serin, treonin eller tyrosin. Denne prosessen utføres av enzymer som kalles proteinkinaser. Når en fosfatgruppe festes til et protein, skjer det en strukturell endring i proteinet som kan:
- Aktivere proteinet (gjøre det funksjonelt).
- Inaktivere proteinet (stoppe dets aktivitet).
- Endre hvor i cellen proteinet befinner seg.
- Endre hvilke andre molekyler proteinet kan binde seg til.
Dermed kan fosforylering styre nesten alle aspekter av proteinfunksjon på en rask og reversibel måte.
På- og avkobling – Kinase og fosfatase
Signaloverføring handler ofte om en balanse mellom påslåing og avslåing:
- Proteinkinaser legger til fosfatgrupper og aktiverer ofte målmolekylene.
- Protein-fosfataser fjerner fosfatgrupper og kan dermed deaktivere målmolekylene.
Denne dynamikken gjør det mulig for cellen å kontrollere hvor raskt og hvor lenge et signal skal vare.
GTP-binding – en alternativ bryter
En annen måte å styre proteinaktivitet på er ved hjelp av GTP-binding, spesielt for G-proteiner:
- Når G-proteinet er bundet til GTP, er det i aktiv tilstand.
- Når GTP hydrolyseres til GDP, inaktiveres G-proteinet.
Dette fungerer også som en av/på-bryter, men her er det binding og hydrolyse av et nukleotid (GTP) som styrer aktiviteten i stedet for fosfatgrupper på proteinet selv.
Kontroll av signalrespons
For at celler skal kunne regulere hvor kraftig og hvor lenge et signal virker, må signalveiene styres nøye. Uten slik kontroll kunne signaler blitt for sterke, for svake, eller vedvart for lenge, noe som kan få alvorlige konsekvenser for cellefunksjonen.
Celler bruker flere strategier for å finjustere og avslutte signaloverføringen:
Mekanismer for signalregulering
1. Negativ tilbakekopling
I mange signalveier finnes det innebygde mekanismer der responsen selv fører til hemming av signalveien. Dette kalles negativ tilbakekopling. Når et signal aktiverer en celleprosess, kan den samme prosessen produsere molekyler som hemmer videre aktivering, slik at systemet «bremser» seg selv når målet er nådd. Eksempel: Økt mengde av en aktivert metabolsk produkt kan hemme enzymene som skapte det.
2. Positiv tilbakekopling
Noen ganger forsterkes signalet i stedet for å dempes, i det som kalles positiv tilbakekopling. Her fører responsen til ytterligere aktivering av signalveien. Slike mekanismer kan brukes når det er viktig å få en rask og kraftig respons, som ved blodkoagulasjon eller ved celledeling.
3. Reseptorinaktivering
En av de raskeste måtene å stoppe et signal på er å inaktivere reseptoren som mottar signalet. Dette kan skje ved at reseptoren endrer konformasjon etter binding, slik at den ikke lenger kan aktivere videre signaloverføring, selv om liganden fortsatt er til stede.
4. Reseptorsekvestrering
Ved mer langvarig stimulering kan cellen trekke reseptorene vekk fra celleoverflaten, i små vesikler, i en prosess som kalles reseptorsekvestrering. Reseptorene kan enten resirkuleres tilbake til cellemembranen senere eller brytes ned.
5. Reseptordestruksjon
I noen tilfeller kan reseptorer brytes ned i lysosomer etter sekvestrering. Dette fjerner reseptorene permanent fra celleoverflaten, og gjør cellen mindre følsom for videre stimulering. Dette kalles downregulation av reseptorer og er viktig for å beskytte cellen mot kronisk overstimulering.
Helheten i reguleringen
Ved hjelp av slike mekanismer kan celler sørge for at signalresponsene:
- Ikke blir for sterke.
- Ikke varer for lenge.
- Blir justert i styrke etter behov.
Eksempler på signalveier – blir viktige senere
Eksempler på viktige signalveier
Signaloverføring inne i celler kan følge flere hovedspor, avhengig av hvilken type reseptor som aktiveres og hvilket signalmolekyl som er involvert. Her gjennomgår vi noen av de viktigste signalveiene i kroppen.
GPCR og cAMP/PKA-signalering (adrenalin, glukagon)
Når et signalmolekyl, som adrenalin eller glukagon, binder seg til en G-protein-koblet reseptor (GPCR), aktiveres et G-protein inne i cellen. Dette G-proteinet stimulerer enzymet adenylyl syklase, som omdanner ATP til cyklisk AMP (cAMP).
- cAMP fungerer som en sekundær budbringer og aktiverer proteinkinase A (PKA).
- PKA fosforylerer ulike målproteiner i cellen, noe som fører til endringer i metabolismen, for eksempel økt nedbrytning av glykogen i muskelceller (slik at energi raskt blir tilgjengelig).
Eksempel: Når du løper fra en fare, sørger adrenalin for at musklene får rask tilgang på glukose gjennom denne signalveien.
GPCR og fosfolipase C-signalering (IP₃/DAG → kalsiumfrigjøring)
En annen viktig vei starter også med en GPCR, men i stedet for å aktivere adenylyl syklase, aktiverer G-proteinet her enzymet fosfolipase C (PLC).
- PLC kløyver en membranlipid (PIP₂) til to produkter: inositoltrifosfat (IP₃) og diacylglyserol (DAG).
- IP₃ diffunderer inn i cytosol og binder seg til reseptorer på det endoplasmatiske retikulum, som slipper ut lagret kalsium (Ca²⁺).
- DAG aktiverer proteinkinase C (PKC), som igjen fosforylerer andre proteiner.
Økt kalsium og aktivert PKC kan blant annet utløse muskelkontraksjon, sekresjon eller andre raske celleprosesser.
Akt/PI3K-signalering (celleoverlevelse)
En annen RTK-basert vei er Akt/PI3K-signalveien, som særlig handler om celleoverlevelse og metabolisme.
- Når RTK-er aktiveres, rekrutteres og aktiveres PI3-kinase (PI3K).
- PI3K produserer spesielle fosfolipider som fungerer som dokkingsplasser for Akt-kinase.
- Akt aktiveres ved fosforylering og kan nå:
- Hemme pro-apoptotiske faktorer (hindrer celledød).
- Aktivere mTOR, som stimulerer proteinsyntese og cellevekst.
- Øke opptak av glukose i celler.
Denne signalveien er kritisk for å sørge for at celler overlever stress og kan vokse under gunstige forhold.
Kliniske eksempler på forstyrret cellekommunikasjon
For å virkelig forstå betydningen av cellekommunikasjon, må vi også se på hva som skjer når disse signalveiene forstyrres. Flere sykdommer oppstår nettopp på grunn av feil i signaloverføringen, enten ved at signaler blir for sterke, for svake eller feilaktige. La oss gå gjennom to viktige kliniske eksempler:
Koleratoksin: Overaktivering av G-protein-signalering
Ved kolerainfeksjon, forårsaket av bakterien Vibrio cholerae, produseres et toksin som forstyrrer den normale reguleringen av G-proteiner i tarmepitelet.
- Normalt sett aktiveres G-proteiner midlertidig når en ligand binder seg til en GPCR, og deretter slår de seg raskt av igjen.
- Koleratoksin låser G-proteinet i en aktiv tilstand, slik at adenylyl syklase stimuleres kontinuerlig.
- Dette fører til vedvarende høy produksjon av cAMP inne i tarmcellene.
Det høye nivået av cAMP stimulerer overdreven sekresjon av vann og elektrolytter (spesielt kloridioner) ut i tarmens lumen. Konsekvensen blir massiv diaré og alvorlig væsketap, noe som kan være livstruende hvis det ikke behandles raskt med væske- og elektrolytt-erstatning.
Dette eksemplet viser hvordan ukontrollert aktivering av en signalvei kan få dramatiske fysiologiske konsekvenser.
Cystisk fibrose: Svikt i regulering av ionetransport (Eksamensmat!)
Cystisk fibrose (CF) er en genetisk sykdom som skyldes mutasjoner i CFTR-genet (Cystic Fibrosis Transmembrane Conductance Regulator).
- CFTR-proteinet fungerer normalt som en kloridkanal i cellemembranen på epitelceller.
- Denne kanalen reguleres av cAMP og aktiveres via G-protein-signalering.
- Ved cystisk fibrose fungerer ikke CFTR-kanalen som den skal. I mange tilfeller blir den enten ikke laget, feilfoldet eller ikke transportert til cellemembranen.
Resultatet er at kloridioner ikke transporteres effektivt ut av cellene. Dette fører til:
- Tykt, klebrig slim i luftveiene.
- Kroniske lungeinfeksjoner og pusteproblemer.
- Problemer med sekresjon i bukspyttkjertelen, som påvirker fordøyelsen.
Mens koleratoksin gir overaktivering av en normal kanal (via cAMP), skyldes cystisk fibrose tap av normal funksjon i en viktig kanal. Begge sykdommene illustrerer hvor avgjørende riktig regulering av cellekommunikasjon og ioneflyt er for helsen vår.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3