Disclaimer: Ikke helt ferdig, skal revi
Alle celler i kroppen har en slags «livssyklus»: de blir til, vokser, deler seg, og til slutt dør de. Celledød er derfor like naturlig og nødvendig som celledeling. Det kan kanskje virke brutalt, men det er nettopp gjennom nøye regulert celledød at kroppen opprettholder balansen mellom vekst og stabilitet – mellom utvikling og kontroll.
Hvorfor må celler dø?
Uten celledød ville kroppen vår raskt blitt overfylt av celler som ikke lenger har en funksjon – gamle, skadde eller farlige celler ville blitt værende i vevet, og nye celler ville ikke fått plass. Samtidig ville immunforsvaret blitt forstyrret, og vevsmiljøet kunne endt i kaos.
Det finnes flere grunner til at celler må fjernes:
- Under fosterutviklingen formes organer og strukturer ved at celler dør der de ikke trengs, som når fingrene separeres.
- I voksen kropp dør celler kontinuerlig for å gi plass til nye. Dette kalles vevshomeostase.
- Skadde celler, for eksempel med mutasjoner eller virusinfeksjon, må fjernes før de gjør skade.
- Immunceller som reagerer på egne celler (autoreaktive) må destrueres for å unngå autoimmune sykdommer.
Ulike former for celledød
Celledød kan grovt deles i to hovedformer:
- Apoptose – programmert celledød
- Nekrose – ikke-programmert, ofte akutt celledød
Apoptose er en nøye regulert prosess hvor cellen selv setter i gang en slags selvmordsmekanisme. Den gjør dette ryddig og kontrollert, uten å skade omkringliggende celler. Resultatet er små, membraninnpakkede fragmenter som raskt ryddes bort av immunsystemet – uten inflammasjon.
Nekrose, derimot, skjer vanligvis ved plutselig skade – for eksempel når blodtilførselen til et vev stopper. Cellen sveller opp, sprekker, og innholdet lekker ut. Dette utløser en kraftig betennelsesreaksjon.
Celledeling og celledød – en balanse
I de fleste modne vev er det en balanse mellom hvor mange celler som dannes og hvor mange som dør. Hvis for mange celler dør og for få lages, kan det gi atrofi eller organsvikt. Omvendt, hvis for få celler dør, og de samtidig deler seg ukontrollert, kan det danne grunnlag for kreft. Derfor er celledød – spesielt apoptose – avgjørende for å opprettholde kontroll over vevsstruktur og funksjon.
Apoptose i mikroskopet – kjennetegn og konsekvenser
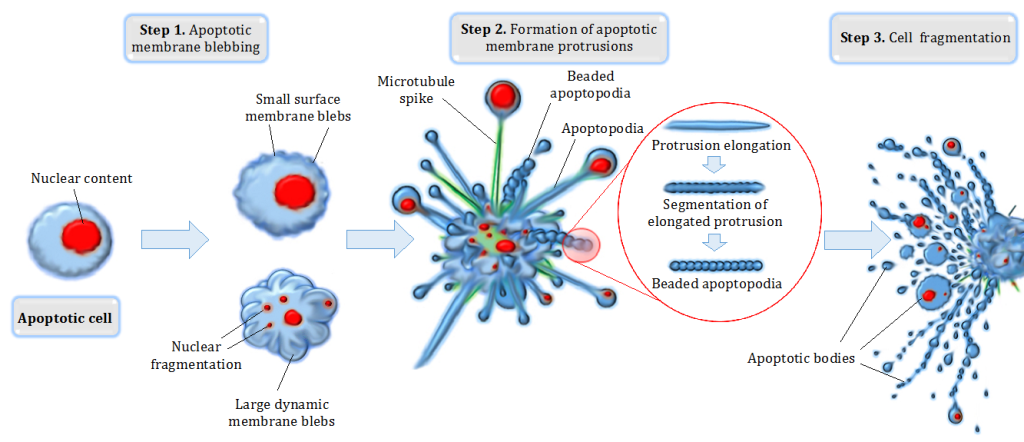
Når vi ser på vev i mikroskopet, kan vi faktisk se forskjell på ulike typer celledød – og apoptose har noen svært karakteristiske trekk. Disse kjennetegnene hjelper oss å forstå at apoptose er en aktiv og kontrollert prosess, hvor cellen «pakker sammen» sitt eget innhold og forlater fellesskapet uten å skape uro.
Hva skjer med cellen under apoptose?
Fra utsiden virker det nesten som om cellen gjør en verdig sorti. I stedet for å sprekke og lekke ut alt sitt innhold, som ved nekrose, trekker den seg sammen og går stille bort. Dette skjer trinnvis, og ender med at cellen fragmenteres i små biter – såkalte apoptotiske legemer – som umiddelbart spises opp av omkringliggende celler og makrofager.
Her er noen mikroskopiske trekk som kjennetegner apoptose:
- Cellen krymper i størrelse, og løsner fra naboceller
- Cytoskjelettet kollapser, som fører til endret form
- Cellemembranen forblir intakt, men danner små bobler (blebs)
- Kjernemembranen oppløses, og DNA fragmenteres
- Det dannes små, membraninnpakkede biter (apoptotiske legemer)
- Ingen inflammasjon oppstår – immunsystemet forholder seg rolig
Et viktig poeng er at apoptose skjer raskt og ryddig. Døde celler forsvinner ofte så fort at man sjelden ser mange av dem i vevsprøver. Dette er i kontrast til nekrose, hvor celleinnhold lekker ut og trigger en betennelsesreaksjon som tiltrekker immunceller.
Nekrose og inflammasjon – kontrasten til apoptose
Ved nekrose ser bildet helt annerledes ut. Cellen sveller opp, sprenges, og innholdet tømmes ut i vevet rundt. Dette oppfattes av kroppen som en nødsituasjon, og betennelsesceller strømmer til området. Det blir rødhet, hevelse og smerte – det typiske bildet av inflammasjon.
Histologisk kjennetegnes nekrose av:
- Celler som er oppsvulmet og sprekker
- Ustrukturert og oppkludret vev
- Mange immunceller, som forsøker å rydde opp
Hvorfor er forskjellen viktig?
Forskjellen mellom apoptose og nekrose er mer enn bare mikroskopiske trekk – det handler om hvordan kroppen reagerer. Apoptose er en stille prosess som opprettholder orden og forhindrer skade, mens nekrose er et nødtiltak som ofte forverrer skaden.
Derfor er det så viktig at kroppen har mekanismer for å velge apoptose når det er mulig. Det gir færre komplikasjoner og gjør det lettere å bevare vevets struktur og funksjon.
Det molekylære maskineriet bak apoptose
Apoptose er ikke en tilfeldig prosess. Den styres av et komplekst og presist maskineri, hvor spesialiserte proteiner samhandler i en kaskade av hendelser som til slutt fører til at cellen demonteres. Dette maskineriet er så finjustert at når prosessen først er satt i gang, finnes det ingen vei tilbake.
Caspaser – selvmordsmaskinens sentrale aktører
I sentrum av apoptose står en familie av enzymer som kalles caspaser. Navnet kommer fra det de gjør: cysteine-dependent aspartate-directed proteases. Dette betyr at de er proteiner som klipper (proteaser) andre proteiner, og at de gjør det ved å kjenne igjen spesifikke aminosyresekvenser – særlig aspartat.
Caspaser finnes normalt i cellen i en inaktiv form (som pro-caspaser). Først når apoptose skal starte, blir de aktivert ved at de selv blir kuttet – i en prosess kalt proteolytisk kløyving. Det som gjør dette ekstra effektivt, er at aktiverte caspaser kan aktivere flere andre caspaser, i en form for positiv tilbakekobling. Dette gir en kaskadereaksjon – en dominoeffekt – som raskt fører til full nedbrytning av cellens indre struktur.
Vi deler caspaser inn i to grupper:
- Initiator-caspaser (f.eks. caspase-8 og caspase-9) – starter prosessen
- Effektor-caspaser (f.eks. caspase-3) – gjennomfører nedbrytningen
Hva gjør caspasene?
Når caspase-kaskaden er i gang, begynner cellens indre å demonteres. Caspasene klipper opp viktige proteiner i cytoskjelettet, cellekjernen og DNA-reparasjonsmaskineriet. En særlig viktig hendelse er aktivering av CAD (caspase-activated DNase), som kutter opp DNA i små fragmenter – et karakteristisk trekk ved apoptose.
CAD holdes normalt inaktiv av et protein kalt iCAD. Når caspase-3 klipper iCAD i stykker, slippes CAD fri og går løs på DNA-et. Resultatet kan observeres som et mønster med DNA-bånd i gel-elektroforese – en slags molekylær signatur på at apoptose har skjedd.
Når apoptose først er i gang, finnes det ingen angreknapp
Et viktig prinsipp i apoptosemaskineriet er irreversibilitet. Når initiator-caspasene først er aktivert, går signalet videre med økende fart og styrke. Dette er en biologisk forsikring: det skal ikke være mulig for en celle å “ombestemme seg” midt i prosessen. Når døden er valgt, er løpet kjørt.
Denne irreversibiliteten gir også terapeutisk potensiale: ved å manipulere aktiveringen av caspaser kan vi i teorien få celler til å dø (som i kreftbehandling), eller redde celler fra å dø (som ved hjerneslag).
To veier til apoptose – det indre og det ytre sporet
Apoptose kan starte fra to forskjellige kanter: enten ved at cellen selv merker at noe er galt på innsiden, eller ved at et signal utenfra forteller den at tiden er inne. Disse to hovedveiene kalles den indre og den ytre apoptoseveien. Til tross for ulik oppstart, ender de begge med samme skjebne: aktivering av de effektor-caspasene som bryter ned cellen.
🔹 Den indre veien – når cellen selv skjønner at noe er galt
Den indre veien, også kalt mitokondriell vei, aktiveres av signaler som kommer fra innsiden av cellen. Dette kan være:
- Alvorlig DNA-skade
- Virusinfeksjon
- Mangel på vekstfaktorer
- Oxidativt stress
Felles for disse situasjonene er at cellen “forstår” at den ikke lenger er trygg – og velger å ofre seg for helhetens beste.
I sentrum av denne mekanismen står mitokondriene – cellens kraftverk, som i apoptose blir til cellens henrettelseskammer. Under apoptose åpnes spesielle porer i mitokondriets membran, og et avgjørende protein, cytokrom c, lekker ut i cytosol. Der binder det seg til et adapter-protein kalt Apaf-1, og sammen med ATP danner de det såkalte apoptosomet.
Apoptosomet fungerer som en aktiveringsplattform for caspase-9, som igjen setter i gang caspase-kaskaden og dødsmaskineriet.
Regulering av den indre veien: Bax, Bak og Bcl-2
Åpningen av mitokondrieporene styres av en balanse mellom pro-apoptotiske og anti-apoptotiske proteiner:
- Bax og Bak fremmer apoptose ved å danne porer i mitokondriemembranen.
- Bcl-2 og Bcl-xL hemmer denne prosessen og holder porene lukket.
Ved DNA-skade aktiveres p53, som blant annet øker produksjonen av Bax/Bak og hemmer Bcl-2 – og dermed åpnes porten til apoptose.
Den ytre veien – når kroppen gir dødsbeskjeden
I den ytre veien kommer signalet utenfra cellen – ofte fra immunsystemet. For eksempel kan en cytotoksisk T-celle gjenkjenne en virusinfisert celle og sende et dødssignal. Dette skjer via spesialiserte dødsligander som binder til dødreseptorer på målcellens overflate.
Et kjent eksempel er Fas-ligand som binder til Fas-reseptoren (også kalt CD95). Når reseptoren aktiveres, rekrutteres adapterproteiner og inaktive caspase-8 samles i et kompleks kalt DISC (Death-Inducing Signaling Complex). Caspase-8 aktiveres, og dette starter caspase-kaskaden på lik linje med den indre veien.
Sammenfallende slutt – aktivering av caspase-3
Både den indre og ytre veien fører til aktivering av den sentrale effektorcaspasen caspase-3. Derfra settes selve nedbrytningen i gang: DNA kuttes, cytoskjelett brytes ned, og cellekroppen pakkes sammen i små biter.
De to veiene er altså som to forskjellige innganger til samme maskin – og når først maskinen er i gang, fullføres dødsprosessen presist og irreversibelt.
Apoptose i utvikling, sykdom og behandling
Apoptose er ikke bare et elegant biologisk fenomen – det har dype røtter i både utviklingsbiologi og medisinsk praksis. Å forstå når og hvorfor celler velger å dø, er avgjørende for å forstå en rekke sykdommer – fra medfødte misdannelser til kreft og autoimmune lidelser.
Apoptose i normal utvikling
Under fosterutviklingen er apoptose helt avgjørende for å forme kroppens strukturer. Når vi ser på en hånd under utvikling, starter den som en «paddehånd» uten tydelige fingre. Det er først når celler i mellomrommet mellom fingrene går i apoptose at fingrene skilles fra hverandre. Hvis denne prosessen ikke fungerer, kan man få sammenvokste fingre eller tær – en tilstand som kalles syndaktyli.
Apoptose spiller også en rolle i hjernens utvikling. I fosterlivet dannes det flere synapser og nevroner enn det som til slutt trengs. De som ikke får tilstrekkelig stimuli, elimineres ved apoptose – en slags nevrologisk naturlig seleksjon som former hjernen.
Apoptose i ferdig utviklet vev
Hos voksne opprettholder apoptose balansen i vev ved å fjerne celler som:
- er skadet eller har mistet funksjonen sin
- er overflødige etter infeksjoner
- kan utvikle seg til kreft
- reagerer på kroppens egne celler (autoreaktive immunceller)
I de fleste vev finnes det en likevekt mellom celledød og celledeling. For eksempel i tarmepitelet erstattes celler kontinuerlig, og apoptose sørger for at gamle celler dør og forsvinner uten å skape betennelse.
Når apoptose svikter: Kreft
Et kjennetegn ved kreftceller er at de ikke bare deler seg ukontrollert – de nekter også å dø. Mange kreftformer har mutasjoner som blokkerer apoptose, for eksempel ved:
- Tap av funksjon i p53, en tumorsuppressor som normalt igangsetter apoptose ved DNA-skade
- Overuttrykk av Bcl-2, som hemmer mitokondriell apoptose
- Nedregulering av dødreseptorer
Dette gjør at celler med alvorlige mutasjoner kan overleve, akkumuleres og danne tumor.
Når apoptose går for langt: Autoimmune og degenerative sykdommer
Apoptose kan også være overaktiv, og føre til sykdom. Eksempler inkluderer:
- Autoimmune sykdommer, hvor immunceller som burde vært fjernet ved apoptose, overlever og angriper kroppens egne vev
- Nevrodegenerative sykdommer som Alzheimer og Parkinson, hvor hjerneceller dør i for høyt tempo
Behandling: Kan vi manipulere apoptose?
Fordi apoptose er så sentral i sykdom, har det blitt et stort satsningsområde innen terapi. Strategiene er delt i to hovedgrupper:
Aktivering av apoptose
Brukes særlig i kreftbehandling. Eksempler:
- Kjemoterapi og stråling: skader DNA og aktiverer apoptose
- Målrettede legemidler: kan etterligne pro-apoptotiske signaler
- Immunterapi: T-celler induserer apoptose i tumorceller
Et konkret eksempel er HPV (humant papillomavirus), som produserer et protein som bryter ned p53. Dette gjør at cellen ikke går i apoptose ved DNA-skade – og øker dermed kreftrisiko. Dette brukes ofte som eksempel i eksamensspørsmål.
Hemming av apoptose
Brukes i situasjoner hvor man ønsker å redde celler som ellers ville dødd, som for eksempel:
- Hjerneslag: forsøk på å hemme apoptose i randsonen rundt skaden (penumbra)
- Autoimmune sykdommer: som systemisk lupus erythematosus (SLE), hvor man gir legemidler som stimulerer apoptose i overaktive B-celler (f.eks. belimumab, som blokkerer overlevelsesfaktoren BLyS)
Begrepsliste
Begrepsliste: Apoptose
🔹 Apoptose
En form for programmert celledød hvor cellen dør på en kontrollert og ryddig måte, uten å skape inflammasjon. Viktig for utvikling, vevsvedlikehold og fjerning av skadde celler.
🔹 Nekrose
Ukontrollert celledød som ofte skyldes akutt skade (som iskemisk vev). Cellen sveller, sprekker og lekker innholdet sitt – noe som fører til betennelsesreaksjon.
🔹 Caspaser
Enzymfamilie (proteaser) som starter og fullfører apoptose ved å klippe spesifikke proteiner. Finnes i inaktiv form (pro-caspaser) og aktiveres ved proteolytisk kløyving.
- Initiator-caspaser: Starter apoptosekaskaden (f.eks. caspase-8 og -9)
- Effektor-caspaser: Utfører selve celledrapet (f.eks. caspase-3)
🔹 Caspase-kaskade
En serie aktiveringer der en aktiv caspase aktiverer flere nye caspaser, som igjen aktiverer flere – en selvforsterkende prosess.
🔹 Positiv tilbakekobling
Når aktiverte caspaser fører til aktivering av enda flere caspaser – prosessen eskalerer og blir irreversibel.
🔹 CAD (Caspase-Activated DNase)
Et enzym som kutter opp DNA i små fragmenter under apoptose. Det aktiveres når caspase-3 klipper iCAD.
🔹 iCAD
Inhibitor av CAD. Holder CAD inaktiv frem til den fjernes av caspase-3.
🔹 Mitokondrievei (indre vei)
Apoptosesignal som starter inne i cellen – f.eks. etter DNA-skade. Mitokondriene slipper ut cytokrom c, som aktiverer caspase-9 via apoptosomet.
🔹 Dødreseptorvei (ytre vei)
Apoptose som starter utenfra, typisk ved binding av ligander (f.eks. FasL) til reseptorer (f.eks. Fas) på celleoverflaten. Aktiverer caspase-8 via DISC-komplekset.
🔹 Cytokrom c
Protein fra mitokondriene som slippes ut ved indre apoptosesignal. Binder til Apaf-1 og danner apoptosomet som aktiverer caspase-9.
🔹 Apaf-1
Adapter-protein som binder cytokrom c og hjelper til å danne apoptosomet.
🔹 Apoptosom
Et kompleks av cytokrom c, Apaf-1 og ATP. Aktiverer caspase-9 og dermed resten av apoptosekaskaden.
🔹 Fas-reseptor (CD95)
En dødreseptor på celleoverflaten som kan binde Fas-ligand og utløse ytre apoptosevei.
🔹 Fas-ligand (FasL)
Et protein uttrykt på immunceller (bl.a. cytotoksiske T-celler) som kan binde Fas-reseptorer og aktivere apoptose.
🔹 DISC (Death-Inducing Signaling Complex)
Et kompleks som dannes når Fas-reseptor aktiveres. Aktiverer caspase-8.
🔹 Bax og Bak
Pro-apoptotiske proteiner som danner porer i mitokondriets ytre membran slik at cytokrom c kan slippes ut.
🔹 Bcl-2
Anti-apoptotisk protein som hindrer at Bax og Bak danner porer i mitokondriene.
🔹 p53
Tumorsuppressor-protein som kan aktivere apoptose ved DNA-skade, blant annet ved å regulere Bax, Bak og Bcl-2. Inaktiveres ofte ved kreft.
🔹 HPV (Humant papillomavirus)
Virus som kan uttrykke proteiner som bryter ned p53 og dermed hemmer apoptose. Øker risiko for kreft.
🔹 Syndaktyli
Tilstand med sammenvokste fingre eller tær. Skyldes manglende apoptose under fosterutviklingen.
🔹 BLyS
Overlevelsesfaktor for B-celler. Hemmes av legemidlet belimumab i behandling av SLE.
🔹 Belimumab
Antistoff som blokkerer BLyS, og dermed fører til apoptose av overaktive B-celler ved lupus (SLE).
🔹 Systemisk lupus erythematosus (SLE)
Autoimmun sykdom hvor apoptose av B-celler kan være en behandlingsstrategi.
🔹 Autoimmune sykdommer
Tilstander der immunceller angriper kroppens egne celler. Kan skyldes svikt i apoptose av autoreaktive celler.
🔹 Nevrodegenerative sykdommer
Sykdommer der nerveceller dør, ofte via overaktiv apoptose (f.eks. Alzheimer og Parkinson).
🔹 Penumbra
Område rundt vevsskade (f.eks. etter hjerneslag) hvor cellene fortsatt lever, men står i fare for å dø. Målet er å redde cellene ved å hemme apoptose.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3