Aminosyrer – byggesteinene i proteinene
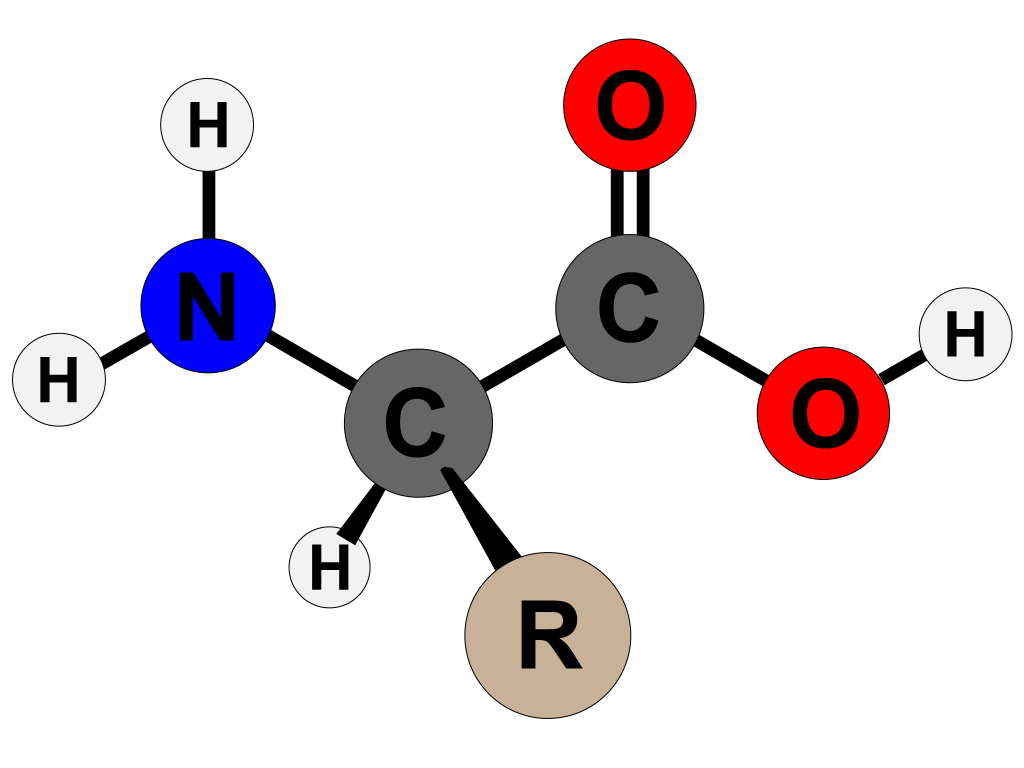
Alle proteiner i kroppen vår er bygd opp av aminosyrer, små organiske molekyler med en struktur som gjør dem unike. Hver aminosyre består av en sentral karbonatom, kalt alfa-karbonet, som danner kjernen i molekylet. Til dette karbonatomet er det festet fire grupper:
- En aminogruppe (-NH₂)
- En karboksylsyregruppe (-COOH)
- Et hydrogenatom
- En sidekjede (R-gruppe), som varierer mellom ulike aminosyrer
Det er denne sidekjeden som bestemmer aminosyrens individuelle egenskaper. Noen sidekjeder er polare og vannløselige, mens andre er upolare og hydrofobe. Noen bærer elektrisk ladning – og dette har stor betydning for proteinets struktur og funksjon.
De fleste naturlig forekommende aminosyrene i kroppen finnes i det som kalles L-konfigurasjon, som handler om hvordan atomene er orientert i rommet. Dette er viktig for hvordan proteinene brettes og fungerer.
Ionisering
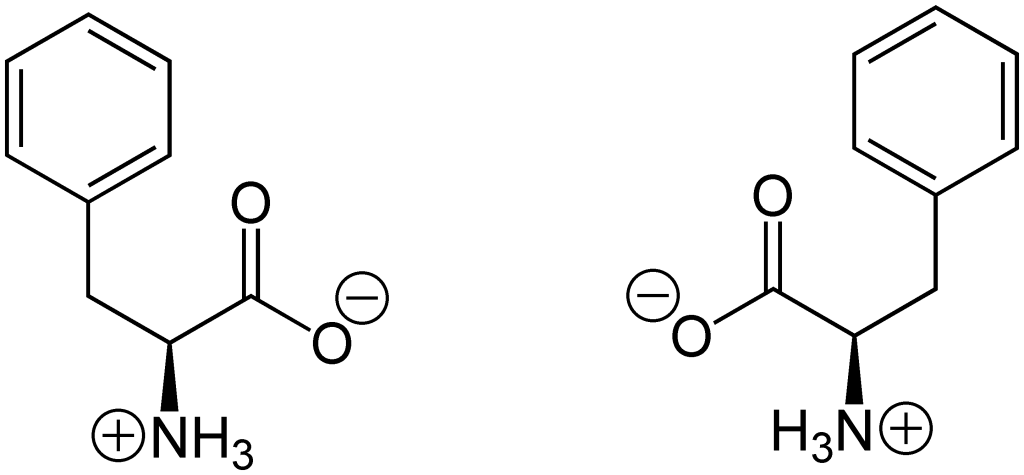
Aminosyrer har ioniseringsegenskaper, altså evne til å bære elektrisk ladning, og dette påvirkes av pH i omgivelsene. Både aminogruppen og karboksylsyregruppen kan ta opp eller avgi protoner (H⁺), og på den måten bli ladet.
- Aminogruppen har en pKa på ca. 9,5, og vil vanligvis være positivt ladet ved fysiologisk pH (rundt 7,4)
- Karboksylgruppen har en pKa på ca. 2,2, og vil være negativt ladet ved samme pH
Ved pH mellom 4 og 8 er begge gruppene ladet – men med motsatt ladning. Dette gjør at aminosyren opptrer som et zwitterion – et molekyl som samtidig har både en positiv og en negativ ladning, men som totalt sett er elektrisk nøytralt.
Når aminosyrene kobles sammen i en polypeptidkjede (et protein), forsvinner disse ladningene for de fleste aminosyrene – fordi aminogruppen og karboksylgruppen danner peptidbindinger. Det er bare de frie endene – N-terminalen (aminosiden) og C-terminalen (karboksylsiden) – som fortsatt kan være ionisert.
Proteiners ladning – surt eller basisk?
Proteiners totale ladning i en gitt løsning bestemmes av hvilke aminosyrer de inneholder:
- Hvis et protein inneholder mange sure aminosyrer, som glutaminsyre og asparaginsyre, vil det ha en negativ ladning og være surt.
- Hvis det derimot inneholder mange basiske aminosyrer, som arginin, lysin, og til en viss grad histidin, vil det være positivt ladet og basisk.
Disse ladningsegenskapene påvirker hvordan proteinet folder seg, hvor det lokaliseres i cellen, og hvordan det interagerer med andre molekyler.
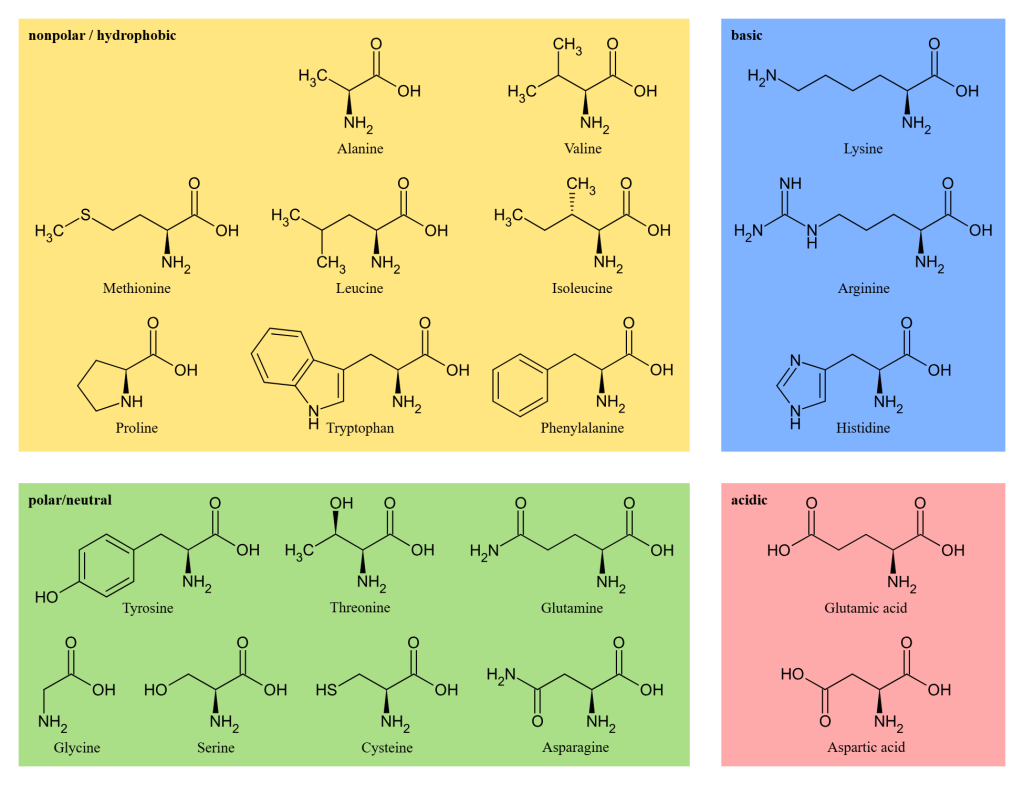
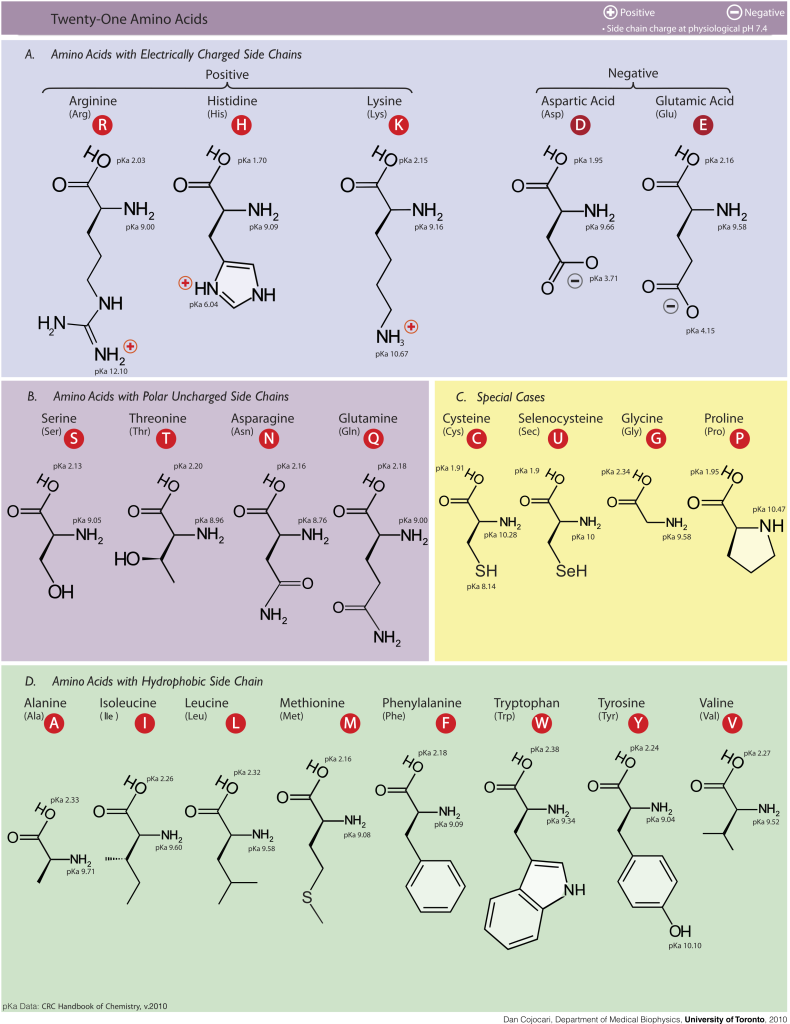
Aminosyrenes inndeling
Alle proteiner, uansett om de finnes i muskel, hud eller enzymer i leveren, er satt sammen av de samme 20 aminosyrene. Det som skiller dem fra hverandre er sidekjeden.
Disse sidekjedene varierer i kjemisk struktur og bestemmer hvordan aminosyren vil oppføre seg: om den vil søke seg mot vann eller bort fra det, om den vil tiltrekke eller frastøte andre ladninger, eller om den kanskje foretrekker å inngå spesielle bindinger med naboene sine.
Vi deler derfor aminosyrene inn i fire hovedkategorier, ut fra hva slags sidekjede de har.
Polare og hydrofile aminosyrer
En del aminosyrer har sidekjeder som verken er ladet eller i stand til å danne hydrogenbindinger. Disse kalles apolære eller hydrofobe, og deres viktigste fellestrekk er at de ikke trives i vannholdige omgivelser. I vannløselige proteiner vil de derfor helst samles i det indre av proteinstrukturen – vekk fra det vandige miljøet som omgir dem. Her inne stabiliseres de ved hjelp av svake, men mange, van der Waals-krefter mellom sidekjedene.
Blant de enkleste hydrofobe aminosyrene finner vi glycin og alanin. Glycin er den aller minste aminosyren, med kun ett hydrogen som sidegruppe, og er dermed svært fleksibel. Alanin har en enkel metylgruppe (–CH₃) som sidekjede, og oppfører seg på en nøytral og lite reaktiv måte.
Flere hydrofobe aminosyrer har større og mer forgrenede sidekjeder. Valin, leucin og isoleucin har alle forgrenede alifatiske kjeder, som gir strukturell støtte til proteinets kjerne. De er essensielle for å bygge opp det hydrofobe interiøret i mange proteiner, og bidrar til at strukturen holder seg stabil.
Metionin er også en apolær aminosyre. Den har en lengre sidekjede som inneholder et svovelatom, men dette svovelet er omgitt av hydrokarboner, og deltar ikke i dannelsen av disulfidbindinger slik cystein gjør. Metionin er særlig kjent for sin rolle i proteinsyntesen, der den alltid er den første aminosyren som settes inn i en ny polypeptidkjede.
Dette skyldes at startkodonet i mRNA (AUG) koder for metionin. Hos mange proteiner fjernes metioninet senere gjennom posttranslasjonell modifisering.
Fenylalanin og tryptofan skiller seg ut med sine store, aromatiske ringer, som gjør dem både stabile og lite løselige i vann. Disse strukturene er delvis stive og kan delta i såkalte π–π-interaksjoner, som også bidrar til proteinets tredimensjonale struktur.
Til slutt har vi prolin, en aminosyre med en helt spesiell struktur. Sidekjeden danner en ring som bøyer seg tilbake og binder seg til aminosyrets egen aminogruppe. Dette gjør prolin til en såkalt iminosyre, og gir opphav til en stiv og karakteristisk knekk i polypeptidkjeden. Prolin opptrer derfor ofte i områder der proteinet må skifte retning, som i knekker eller svinger i proteinets struktur.
Basiske aminosyrer – de med positiv ladning
En liten gruppe aminosyrer kjennetegnes ved at sidekjedene deres bærer en positiv ladning ved fysiologisk pH (~7,4). Disse aminosyrene kalles basiske, fordi de kan ta opp protoner og bidra til å heve pH i en løsning. På grunn av den positive ladningen, tiltrekkes de naturlig av negativt ladede strukturer og spiller dermed en sentral rolle i en rekke biologiske prosesser.
De basiske aminosyrene finnes ofte i proteiner som samhandler med DNA, som i seg selv er sterkt negativt ladet på grunn av fosfatgruppene i ryggraden. I tillegg inngår de ofte i aktive seter i enzymer, hvor de kan bidra til katalyse, substratbinding eller pH-avhengige mekanismer.
Lysin har en lang og fleksibel sidekjede som ender i en primær aminogruppe (–NH₃⁺) ytterst. Denne gruppen bærer en stabil positiv ladning og gjør lysin godt egnet til å danne ionebindinger med negative grupper i andre molekyler.
Arginin har en enda mer ladningsstabil gruppe kalt en guanidiniumgruppe i enden av sidekjeden. Denne gruppen er resonansstabilisert og bærer en permanent positiv ladning, noe som gjør arginin spesielt kraftig i elektrostatisk interaksjon med negative ladninger.
Histidin er unik blant de basiske aminosyrene. Den har en sidekjede som består av en imidazolring, som kan veksle mellom å være protonert og nøytral avhengig av det lokale pH-nivået. Ved fysiologisk pH ligger pKa-verdien til histidin nær nok til at ringen ofte veksler mellom ladet og uladet form. Dette gjør histidin ideell i enzymatiske reaksjoner der det trengs finjustert pH-sensitivitet – for eksempel i overføring av protoner i aktive seter.
Sammen utgjør lysin, arginin og histidin de tre klassiske basiske aminosyrene i biokjemien, og deres evne til å binde seg til negative molekyler er avgjørende for mange av proteinets funksjoner.
Et viktig poeng: Hvorfor basisk = viktig for DNA?
En av grunnene til at basiske aminosyrer er så viktige i biologien, er at DNA er negativt ladet. Denne negative ladningen kommer fra fosfatgruppene i DNA-ets sukker-fosfat-ryggrad, som hver bærer én negativ ladning ved fysiologisk pH. Det betyr at DNA fungerer som et polyanion – et langt, fleksibelt, negativt ladet molekyl.
For at cellen skal kunne pakke DNA tett sammen, regulere hvilke gener som er aktive, og organisere kromatin, trengs det proteiner som kan binde seg til DNA på en stabil og kontrollert måte. Her kommer de basiske aminosyrene inn i bildet.
Proteiner som binder DNA – for eksempel histoner, transkripsjonsfaktorer og DNA-polymeraser – er ofte rike på lysin og arginin. Disse aminosyrene gir proteinene en positiv ladning som gjør at de kan binde seg elektrostatisk til DNA. Dette gjelder særlig histonene, som danner kjernen i nukleosomer og tillater DNA å surres tett rundt seg. Det er denne interaksjonen som muliggjør kromatinpakking og epigenetisk regulering.
Histidin, som kan veksle mellom ladet og uladet form, spiller ikke like stor rolle i direkte DNA-pakking, men kan være viktig i proteiner som må reagere på pH-endringer i cellekjernen eller delta i regulering av enzymaktivitet knyttet til DNA.
Dermed er koblingen mellom DNA og basiske aminosyrer et viktig eksempel på hvordan kjemisk ladning styrer biologisk funksjon.
Sure aminosyrer – de med negativ ladning
Aspartat og glutamat utgjør de to klassiske sure aminosyrene. Det som kjennetegner dem, er at sidekjedene deres inneholder en karboksylgruppe (–COOH) som lett avgir et proton (H⁺) ved fysiologisk pH (~7,4). Når dette skjer, blir gruppen negativt ladet (–COO⁻), og aminosyren fungerer som en syre.
Denne negative ladningen gjør at aspartat og glutamat tiltrekker seg positivt ladede grupper og ioner, og de opptrer derfor som motsetninger til de basiske aminosyrene. De spiller en viktig rolle i å danne elektrostatiske interaksjoner og ionebindinger, og er ofte avgjørende for struktur og funksjon i mange proteiner.
I proteiner finnes sure aminosyrer ofte i bindingslommer, der de kan samhandle med positivt ladede molekyler eller metallioner som kalsium (Ca²⁺), magnesium (Mg²⁺) eller sink (Zn²⁺). De kan også være med på å stabilisere proteinkomplekser eller delta i katalytiske reaksjoner i enzymer.
I cellemembraner kan aspartat og glutamat inngå i strukturen til ionekanaler, der de bidrar til selektiv ionetransport. De kan også være viktige for å opprettholde elektrisk ladning over membraner, for eksempel i nerveceller og mitokondrier, der små ladningsforskjeller er essensielle for cellens funksjon.
Til tross for sine like egenskaper, skiller de to seg litt i struktur: Aspartat har en kortere sidekjede, mens glutamat har én ekstra –CH₂–gruppe i kjeden, noe som gjør den litt mer fleksibel i interaksjoner.
Peptidbindinger – hvordan aminosyrer kobles sammen
Alle aminosyrer har to sentrale funksjonelle grupper som gjør dem i stand til å bindes sammen i kjeder: en aminogruppe (–NH₂) og en karboksylgruppe (–COOH). Når to aminosyrer møtes, kan disse gruppene reagere med hverandre i en kondensasjonsreaksjon, der et vannmolekyl (H₂O) fjernes, og en sterk kovalent binding dannes. Dette er den såkalte peptidbindingen – selve grunnlaget for proteinsyntese.
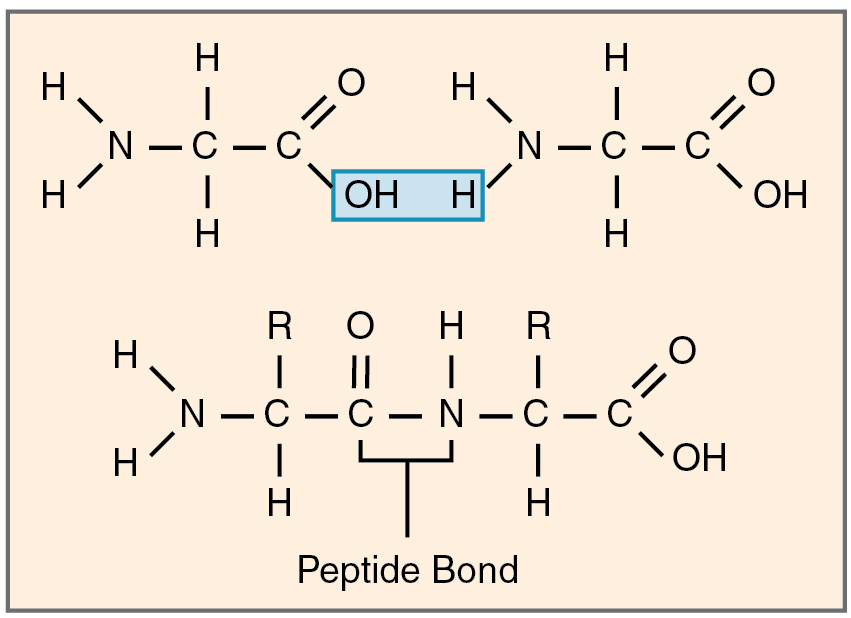
Peptidbindingen dannes mellom karbonet i karboksylgruppen på den ene aminosyren og nitrogenet i aminogruppen på den neste. Resultatet er en ny kjemisk struktur – et dipeptid, som altså består av to aminosyrer koblet sammen.
Denne prosessen kan gjentas igjen og igjen, og det dannes da lange kjeder av aminosyrer, kjent som polypeptider. Når en slik kjede folder seg på riktig måte, får vi et protein – et funksjonelt molekyl med spesialisert struktur.
Selve peptidbindingen er bemerkelsesverdig stabil og har unike egenskaper. Elektronskyene rundt karbonet, oksygenet og nitrogenet i bindingen delvis overlapper og gir bindingen resonansstruktur – med delvis dobbeltbindingsegenskaper. Dette gjør at bindingen ikke kan rotere fritt. Den er altså plan og stiv, som et solid ledd mellom to mer fleksible deler av kjeden. De nærliggende bindingene rundt α-karbonet kan rotere, men selve peptidbindingen forblir rigid.
Denne stivheten er avgjørende for hvordan proteinet folder seg. Selv om polypeptidkjeden kan bøyes og vris på mange måter, er ikke foldingen tilfeldig. Hver aminosyre påvirker hvordan kjeden oppfører seg, og hele strukturen søker å nå den formen som krever minst mulig energi – en energimessig stabil konfigurasjon.
Flere krefter samarbeider for å forme det endelige proteinets tredimensjonale struktur:
– Hydrogenbindinger mellom atomer i kjeden
– Hydrofobe interaksjoner, der vannskyende grupper gjemmes bort
– Ionebindinger mellom ladede sidekjeder
– Disulfidbroer, som dannes mellom cystein-rester og gir ekstra stabilitet
Alt dette sammen bidrar til at proteinet ender opp i en svært presis og funksjonell form. Proteinets form bestemmer dets funksjon – og peptidbindingen danner det molekylære skjelettet som alt bygger på.
I kroppen er det ribosomet som står for dannelsen av peptidbindinger under proteinsyntesen. Her hjelper et enzym kalt peptidyltransferase med å koble aminosyrene sammen én etter én, mens mRNA dikterer rekkefølgen. Hver gang en ny aminosyre legges til, dannes en ny peptidbinding – og et vannmolekyl frigjøres.
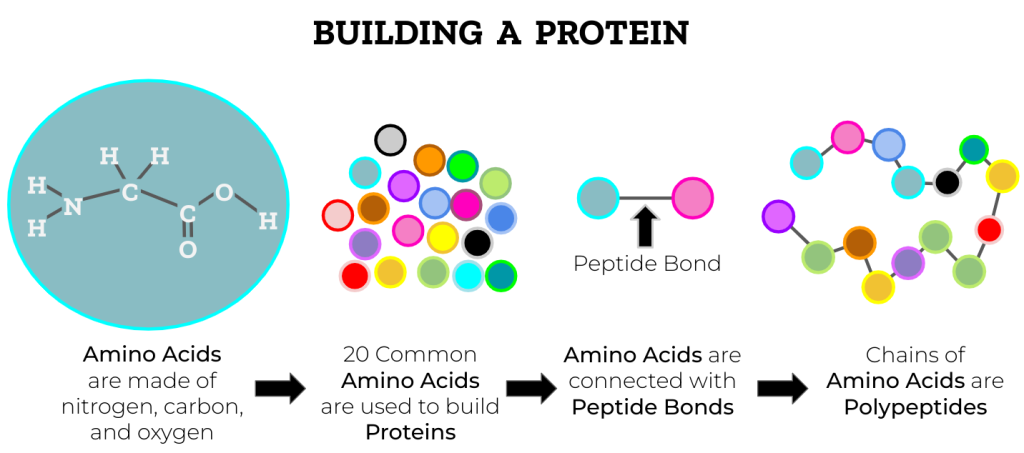
Kjemiske bindinger som former proteinet
Et protein er langt mer enn en rett kjede av aminosyrer. For at det skal fungere riktig i kroppen, må det ikke bare ha riktig sekvens, men også en korrekt og spesifikk tredimensjonal struktur. Denne formen – proteinets konformasjon – er avgjørende for funksjonen, enten det er snakk om enzymaktivitet, signaloverføring eller transport.
Foldingen til denne strukturen styres og stabiliseres av en rekke kjemiske bindinger og interaksjoner. Disse virker sammen for å oppnå en struktur som er energetisk gunstig og biologisk funksjonell. Under følger en gjennomgang av de viktigste kreftene som påvirker proteinets tredimensjonale form:
Hydrogenbindinger
Hydrogenbindinger oppstår når et hydrogenatom som allerede er bundet til et elektronegativt atom – som nitrogen eller oksygen – trekkes mot et annet nærliggende elektronegativt atom. I proteiner skjer dette ofte mellom atomene i peptidbindingens ryggsøyle, og det er nettopp disse bindingene som stabiliserer proteinets sekundærstruktur.
I en alfa-heliks dannes det hydrogenbindinger mellom karbonylgruppen (C=O) på én aminosyre og aminogruppen (N–H) fire posisjoner lenger ned i kjeden, noe som holder spiralen stabil.
I beta-sheets ligger kjedene flatt ved siden av hverandre, og hydrogenbindingene danner broer mellom kjedene og sørger for at strukturen holder seg stabil og tettpakket.
Individuelt er hydrogenbindinger relativt svake, men fordi det dannes mange slike bindinger i et protein, blir den samlede stabiliteten betydelig.
Elektrostatiske interaksjoner
Disse interaksjonene skjer mellom ladde sidekjeder på aminosyrene. Positive ladninger (som på lysin, arginin og histidin) tiltrekker seg negative ladninger (som på aspartat og glutamat), og danner det vi kaller ionebindinger eller saltbroer. Slike bindinger er spesielt viktige i områder av proteinet der det er lite vann, for eksempel i proteinets indre eller i membranproteiner.
Elektrostatiske krefter er også ansvarlige for frastøting mellom like ladninger, noe som kan føre til at deler av proteinet skyver seg bort fra hverandre. Dette kan påvirke hvordan kjeden folder seg og bidra til at proteinet inntar en struktur som unngår slike energikrevende kollisjoner.
Van der Waals-krefter
Van der Waals-krefter er ekstremt svake, men svært tallrike. De oppstår når elektronskyene til nærliggende atomer påvirker hverandre og skaper midlertidige dipoler, som gir en svak tiltrekning. Hvis atomene kommer for nært, oppstår frastøtning. Når avstanden er akkurat passe – typisk i området for deres van der Waals-radius – er systemet i energetisk likevekt.
Slike interaksjoner er spesielt viktige i proteinets kjerne, der mange atomer ligger tett sammen. Selv om hver enkelt interaksjon er svak, vil et stort antall van der Waals-krefter til sammen gi betydelig stabilitet til strukturen.
Hydrofobe interaksjoner
Blant de viktigste drivkreftene bak proteinfolding er de hydrofobe interaksjonene. Mange aminosyrer, som valin, leucin, isoleucin, fenylalanin og metionin, har sidekjeder som ikke trives i vann – de er upolare og hydrofobe. I en vannholdig løsning vil disse gruppene forsøke å unngå kontakt med vann, og trekker seg innover mot proteinets indre.
Dette fører til dannelsen av en hydrofob kjerne, der de vannskyende gruppene pakkes tett sammen, mens de hydrofile og ofte ladede gruppene vender utover mot vannet i cellens cytosol. Denne tendensen til å skjerme hydrofobe grupper fra vann bidrar sterkt til å bestemme proteinets tredimensjonale struktur.
Proteinstruktur
Proteiner er lange kjeder av aminosyrer som folder seg til bestemte tredimensjonale former. Disse formene er avgjørende for proteinets funksjon, og foldingen skjer spontant basert på egenskapene til hver aminosyre i kjeden. Når et protein folder seg riktig, frigjøres energi i form av varme. Dette betyr at den foldede strukturen er mer stabil og har lavere energi enn den ufoldede kjeden. Samtidig øker entropien i omgivelsene – det vil si at det blir mer uorden rundt, selv om selve proteinet blir mer ordnet.
Proteinets tredimensjonale struktur er forhåndsprogrammert av rekkefølgen på aminosyrene – altså dens primærstruktur.
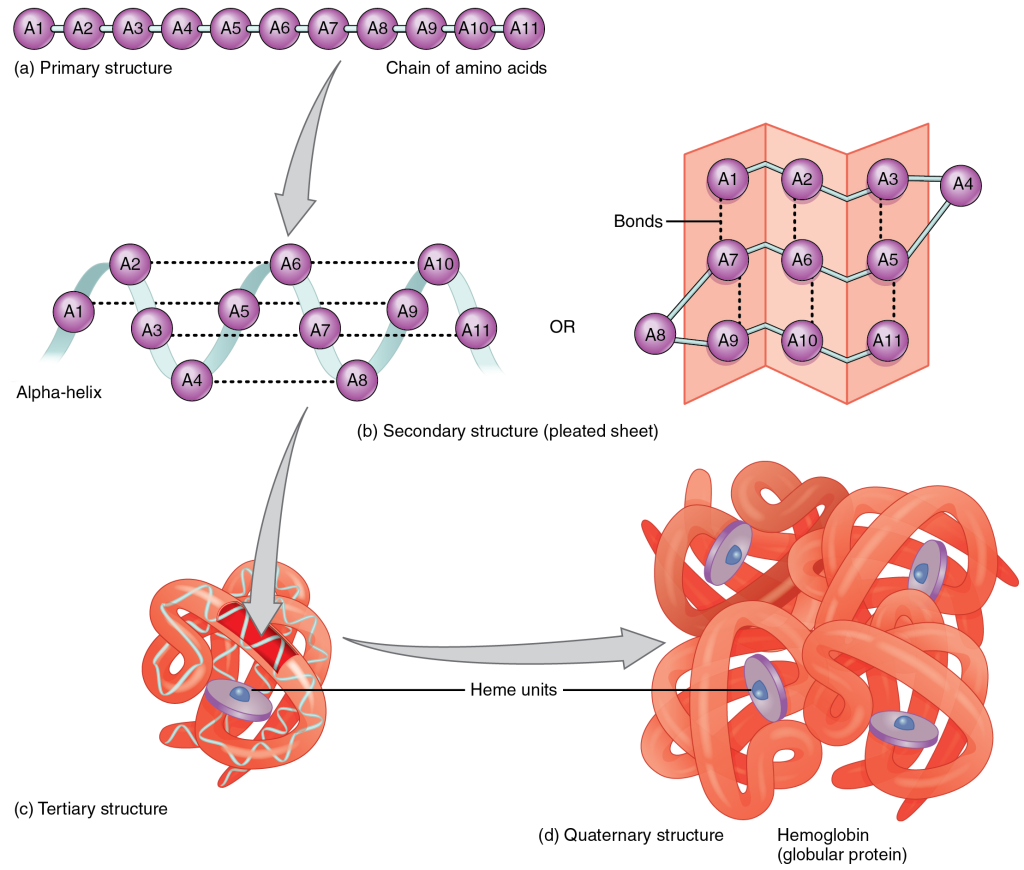
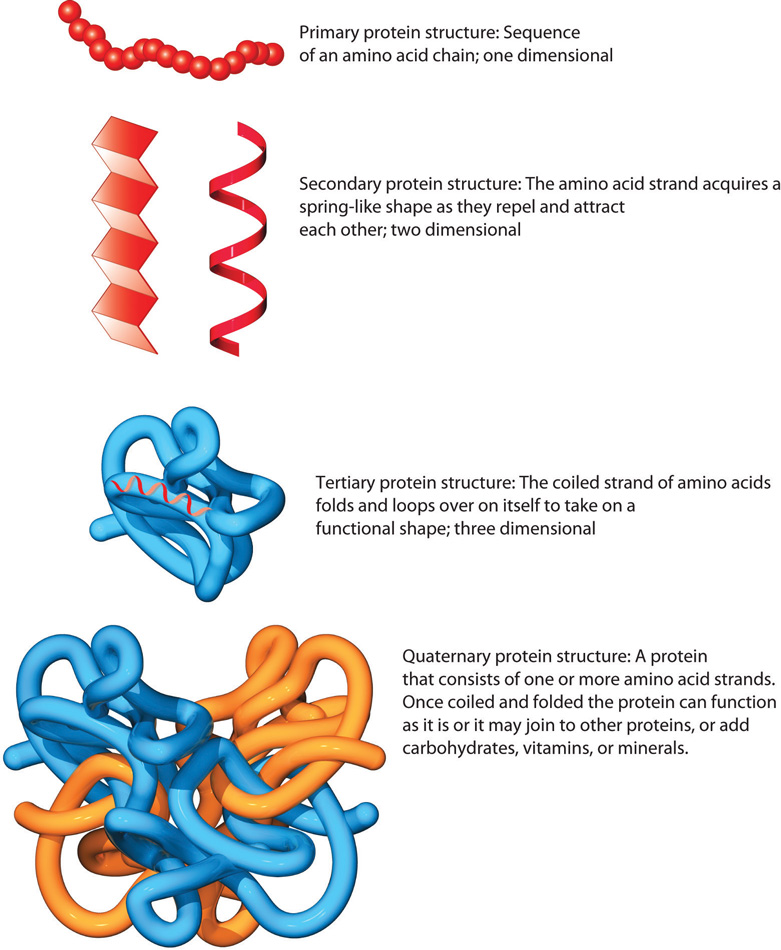
Primærstruktur
Primærstrukturen er den lineære rekkefølgen av aminosyrer i et protein.
Denne sekvensen starter ved N-terminalen (enden med en fri aminogruppe) og slutter ved C-terminalen (enden med en fri karboksylgruppe).
Rekkefølgen er spesifikk og bestemt av genetisk informasjon i DNA.
Hver aminosyre i sekvensen representeres ofte med en forkortelse, for eksempel:
Met-Gly-Thr-Ser-Ala-Lys-Pro
Selv små endringer i primærstrukturen – som én enkelt aminosyre – kan ha stor innvirkning. For eksempel skyldes sigdcelleanemi en eneste mutasjon i hemoglobinmolekylet.

Sekundærstruktur
Når en polypeptidkjede begynner å folde seg mot sin tredimensjonale struktur, skjer det ikke tilfeldig. Tvert imot – proteinets form er styrt av den rekkefølgen aminosyrene kommer i, altså det vi kaller primærstrukturen. Foldingen skjer spontant og naturlig, og den søker alltid mot en struktur med lavest mulig fri energi – det vil si en mest mulig stabil form.
Denne prosessen er termodynamisk gunstig: når proteinet folder seg, frigjøres varme og systemet rundt øker sin entropi (uorden), selv om selve proteinet blir mer strukturert. Dette gjør proteinfolding til en spontan og energimessig lønnsom prosess – så lenge forholdene i cellen ligger til rette.
Den hydrofobe kjernen og den hydrofile overflaten
I vannløselige proteiner ser vi et gjennomgående mønster: de hydrofobe aminosyrene samler seg i proteinets indre, mens de hydrofile aminosyrene vender utover mot vannet. Hvorfor?
Fordi vann er et polart molekyl, og hydrofobe grupper – som ikke har ladning og ikke danner hydrogenbindinger – “misliker” kontakt med vann. Når disse gruppene samler seg innover og skjermer seg fra vannet, og de vannvennlige (hydrofile) gruppene vender utover, senkes proteinets frie energi, og strukturen blir stabil.
Dette er en av de sterkeste drivkreftene bak proteinfolding, og en viktig forklaring på hvorfor mange proteiner ser ut slik de gjør.
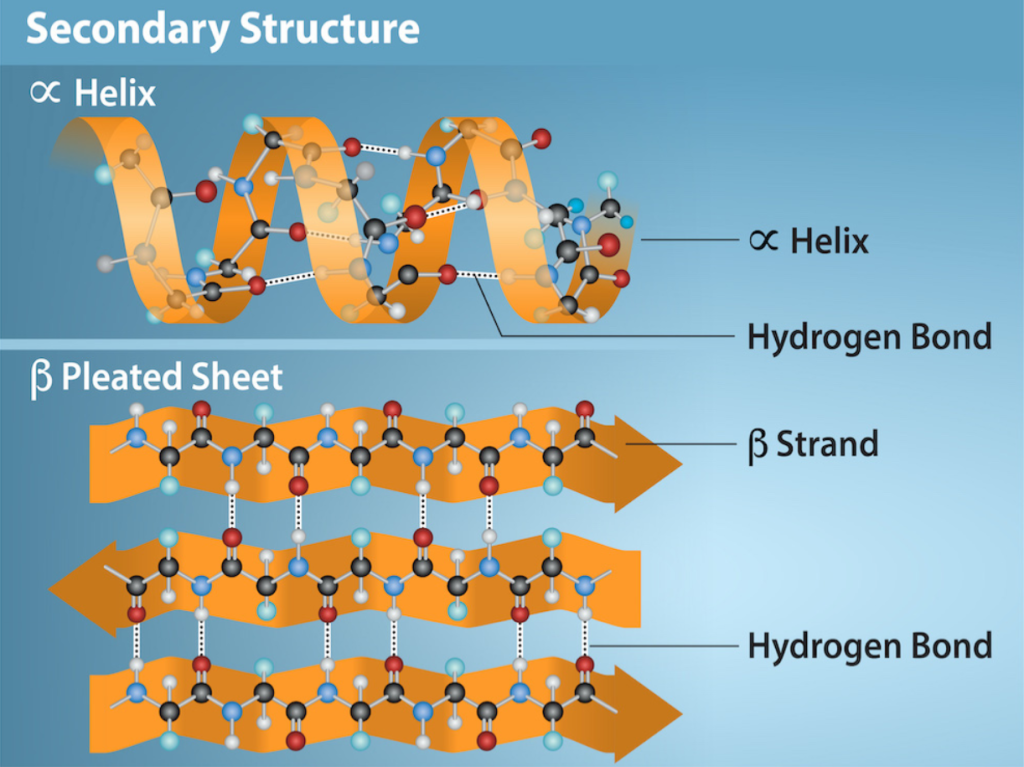
Hva er sekundærstruktur?
Sekundærstruktur er betegnelsen på de lokale foldingsmønstrene som dannes tidlig når proteinkjeden begynner å folde seg.
Disse strukturene er ikke styrt av sidekjedene, men av hydrogenbindinger i selve ryggraden – mellom karbonylgruppen (C=O) og aminogruppen (N–H) i peptidbindingene.
To typer sekundærstruktur dominerer:
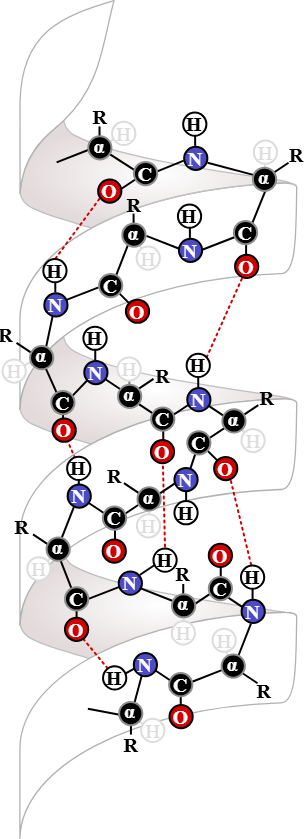
α-heliks (alfa-heliks)
Langs ryggraden i peptidkjeden finner vi karbonylgrupper (C=O) og aminogrupper (N–H) som repeteres for hver aminosyre. Når en del av kjeden danner en alfa-heliks, dannes det hydrogenbindinger mellom disse gruppene, nærmere bestemt mellom:
- C=O-gruppen på én aminosyre, og
- N–H-gruppen fire aminosyrer lenger frem i kjeden.
Denne regelmessige mønstringen av hydrogenbindinger får kjeden til å snurre seg selv inn i en venstrevendt spiral (selv om den ofte kalles “høyredreid” i strukturkjemien), og bindingene ligger parallelt med spiralens akse, som stolpene i en spiraltrapp. Bindingene stabiliserer strukturen og holder spiralen tett sammen.
Sidekjedene (R-gruppene) til aminosyrene peker utover fra heliksen – som tagger på utsiden av en spiral. Dette gjør at heliksen både er kompakt og samtidig tilgjengelig for interaksjon med omgivelsene. Avstanden og retningen på sidekjedene gjør det også mulig å ha en side av heliksen som er hydrofob og en annen som er hydrofil, avhengig av hvilke aminosyrer som inngår – dette er viktig for proteinfolding og membranforankring.
Alfa-heliksen har også en elektrisk egenskap: fordi alle hydrogenbindingene i heliksen peker i samme retning (fra N–H til C=O), oppstår det en samlet elektrisk gradient langs spiralens lengde. Den ene enden blir da delvis positiv (N-terminalen), og den andre delvis negativ (C-terminalen). Dette kalles et dipolmoment, og gjør at heliksen kan binde seg til andre ladede grupper, eller bidra til enzymatisk aktivitet der elektriske ladninger er involvert.
Alfa-helikser er svært vanlige i naturen og finnes i mange viktige proteiner:
- Hemoglobin inneholder flere alfa-helikser som bidrar til oksygenbinding.
- Keratin, som bygger opp hår, hud og negler, er rikt på alfa-helikser som tvinner seg sammen.
- Myosin i musklene bruker lange alfa-helikser som danner fleksible, men sterke strukturer.
- DNA-bindende proteiner bruker ofte alfa-helikser som “nøkler” som passer inn i DNA-ets spiralform og muliggjør spesifikk binding til gener.
β-flak (beta-sheets)
Beta-strukturer dannes når deler av polypeptidkjeden legger seg ut i rette, strukne segmenter, som kalles beta-tråder. Flere slike tråder legger seg ved siden av hverandre, enten i samme retning (parallelt) eller motsatt retning (antiparallelt). De bindes sammen med hydrogenbindinger på tvers, mellom ryggsøylene.
Resultatet er et β-sheet, et flatt og stivt strukturelement som gir proteinet styrke og stabilitet. Disse strukturene er ofte litt vridde, og gir proteinet en form for “ryggrad” som kan bære andre strukturer.
I illustrasjoner vises beta-tråder som piler som peker fra N-terminal til C-terminal. Dette hjelper med å vise orienteringen og om trådene er parallelt eller antiparallelt arrangert.
Beta-strukturer er vanlige i:
- Antistoffer, der de danner stabile rammer rundt bindingsstedene.
- Enzymer, der de fungerer som plattformer som støtter opp de aktive setene.
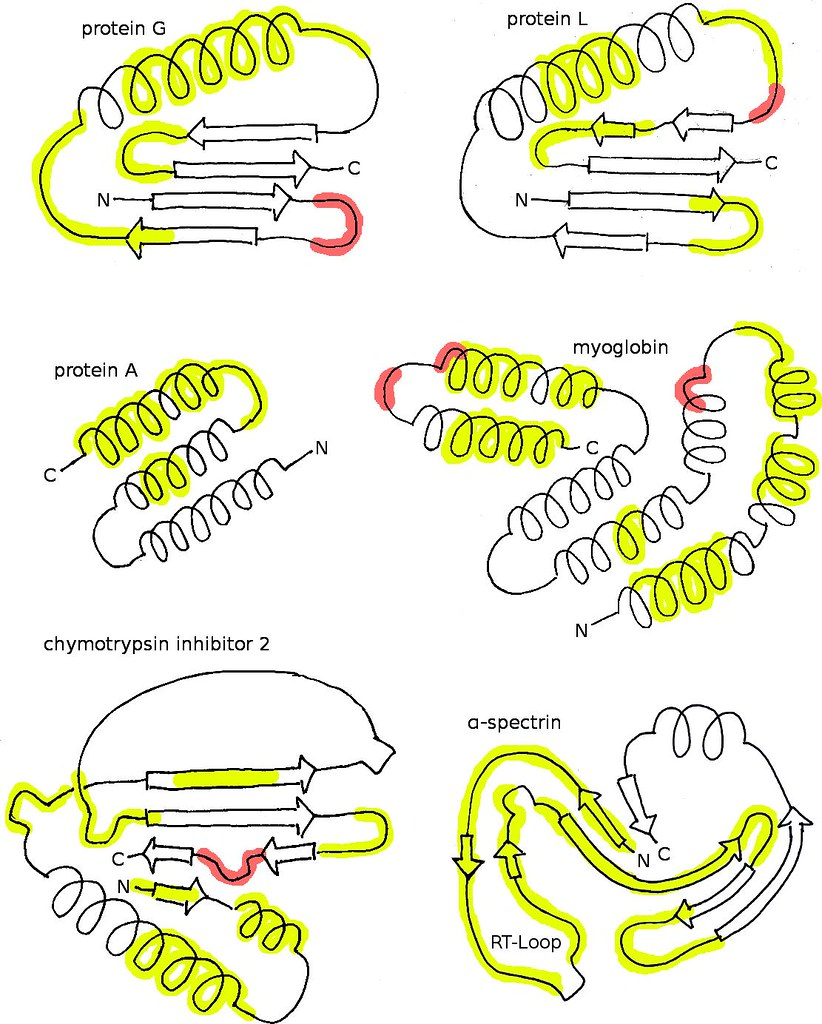
Loops og turns – fleksible koblinger i proteinet
I tillegg til de mer regelmessige strukturene som alfa-helikser og beta-sheets, inneholder de fleste proteiner også fleksible partier. Disse områdene kalles loops eller turns, og fungerer som bøyelige koblinger mellom de mer organiserte delene av proteinet.
Selv om loops ikke danner faste mønstre slik som helikser og flak, har de likevel viktige funksjoner. De gir proteinet fleksibilitet og gjør det mulig å endre form, for eksempel når et enzym skal binde et substrat, eller når et signalmolekyl skal gjenkjennes. Mange loops ligger dessuten på proteinets overflate, der de kan delta i bindingsinteraksjoner, katalyse eller signaloverføring.
Loops og turns er ofte avgjørende for proteinets funksjon – ikke fordi de holder strukturen stabil, men fordi de gir bevegelse og tilgjengelighet der det trengs. Og de ikke er like kritiske for proteinets struktur som helikser og flak ofte er.
Loops er også interessante fra et evolusjonært perspektiv. I motsetning til mange helikser og sheets, som må være svært presise for at proteinet skal foldes riktig, er loops ofte mer variable i både lengde og aminosyreinnhold.
Dette betyr at mutasjoner i loops som regel ikke ødelegger proteinets overordnede struktur eller funksjon, så lenge de fleksible egenskapene bevares. Derfor sier vi at loops er mindre konservative – de kan endre seg over tid uten at proteinets essensielle egenskaper går tapt.
Denne toleransen for variasjon gjør loops til et evolusjonært frirom, der naturlige mutasjoner kan gi opphav til nye funksjoner eller interaksjoner uten å kompromittere proteinets stabilitet.
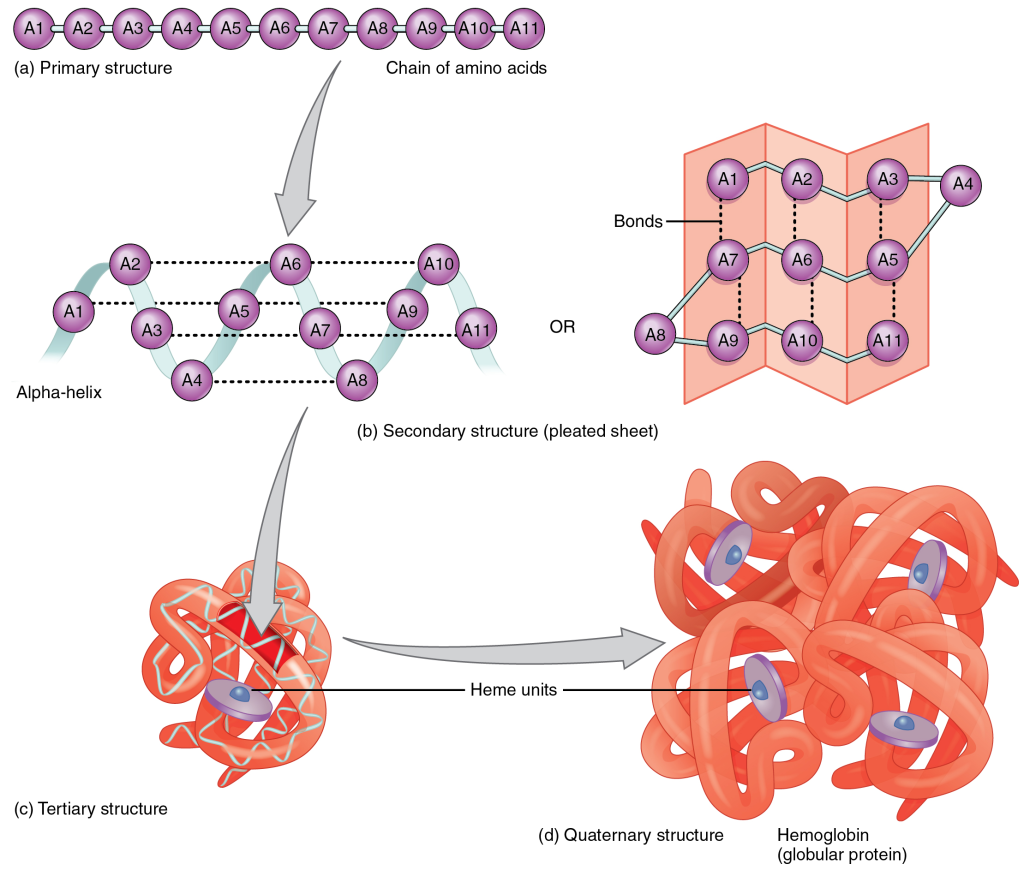
Tertiærstruktur
– proteinets tredimensjonale form
Et protein er ikke ferdig så snart det har dannet spiraler og flak. De ulike delene – alfa-helikser, beta-sheets og løkker – må også finne sin plass i forhold til hverandre i rommet.
Det er dette som kalles tertærstruktur: proteinets endelige tredimensjonale form. Det er her proteinet går fra å være en fleksibel tråd med strukturelle innslag – til å bli et funksjonelt, romlig tilpasset molekyl.
Tertiærstrukturen bestemmes av hvordan de ulike sekundærstrukturelementene pakker seg sammen og organiserer seg rundt den hydrofobe kjernen.
Denne formen er unik for hvert protein, og den er helt avgjørende for at proteinet skal kunne utføre sine spesifikke oppgaver i cellen – enten det er å katalysere reaksjoner, binde til andre molekyler, eller fungere som en transportør.
Hva holder strukturen sammen?
Foldingen til tertiærstrukturen skjer gjennom et komplekst samspill av kjemiske bindinger og fysiske krefter mellom aminosyrene – spesielt mellom sidekjedene deres. Noen trekker mot hverandre, andre skyver hverandre bort. Noen danner sterke broer, andre danner svake, men viktige forbindelser. Sammen sørger de for at proteinet foldes på en presis måte og forblir stabilt.
De viktigste kreftene er:
- Hydrogenbindinger, mellom NH- og CO-grupper eller sidekjeder som kan danne slike bånd
- Ioniske interaksjoner, mellom positivt og negativt ladede aminosyrer
- Van der Waals-krefter, som oppstår når atomer ligger tett, men i perfekt balanse
- Hydrofobe interaksjoner, der vannskyende grupper trekker seg mot proteinets indre
- Disulfidbindinger, sterke kovalente broer mellom cysteinrester, som “låser” strukturen
I tillegg kan tertiærstrukturen påvirkes av eksterne forhold som pH, temperatur og saltkonsentrasjon. Dette er grunnen til at proteiner kan denaturere – altså miste sin struktur og funksjon – hvis miljøet blir for ekstremt.
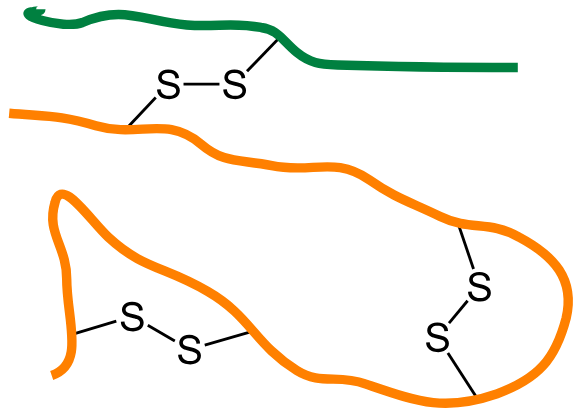
Disulfidbindinger – kjemiske låser i strukturen
Blant de mest avgjørende strukturelle elementene i tertiærstruktur finner vi disulfidbindingene. Disse oppstår mellom to cystein-rester som ligger i nærheten av hverandre i det foldede proteinet. Når svovelatomene i deres sidekjeder oksideres, dannes det en sterk kovalent binding – en disulfidbro – som holder proteinet sammen.
Disulfidbroene virker som kjemiske låser og er spesielt viktige i proteiner som finnes utenfor cellen, der miljøet er mer oksidativt. Der bidrar de til å gjøre proteinet mer robust og motstandsdyktig mot denaturering.
Post-translasjonelle modifikasjoner
Etter at et protein er syntetisert i ribosomet, er det fortsatt ikke nødvendigvis klart til bruk. Mange proteiner gjennomgår kjemiske endringer etter translasjonen – såkalte post-translasjonelle modifikasjoner (PTM). Disse kan være midlertidige eller permanente, og de regulerer blant annet proteinets funksjon, stabilitet, lokalisering og interaksjoner.
Det er identifisert over 400 typer PTM, og mange av dem skjer spesifikt i bestemte celletyper eller som respons på signaler.
De viktigste typene du bør kjenne til er:
Fosforylering
Fosforylering skjer når en fosfatgruppe festes til en OH-gruppe på aminosyrene serin, treonin eller tyrosin. Merk deg at det er disse aminosyrene som har OH gruppe på seg, er derav de som blir fosforylert.
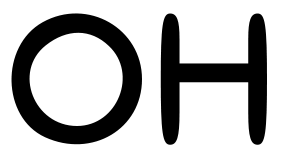
Dette skjer ved hjelp av spesifikke enzymer kalt kinaser.
På andre siden kan fosfatgruppen fjernes igjen av fosfataser.
Fosforylering fungerer ofte som en på- eller av-knapp for enzymer og signalproteiner.
Eksempel: I muskelceller aktiveres enzymet glykogenfosforylase ved fosforylering. Dette starter nedbrytningen av glykogen, slik at cellen får tilgang på energi.
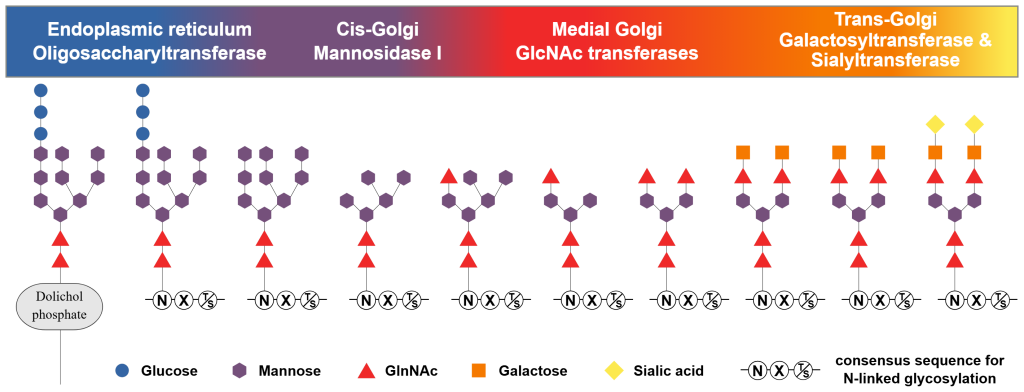
Glykosylering
Her festes sukkerkjeder (oligosakkarider) til proteinet – ofte til sidekjeden på asparagin. Glykosylering er avgjørende for at proteinet skal sorteres riktig inne i cellen og fraktes dit det skal – ofte til cellemembranen.
Sukkerrestene fungerer som identitetsmerker som hjelper cellen å gjenkjenne og kommunisere med andre celler.
Acetylering og metylering
Ved acetylering og metylering festes små kjemiske grupper til spesifikke aminosyrer – ofte på histoner eller transkripsjonsfaktorer – og dette påvirker genregulering, proteinets interaksjoner og dets levetid.
Kvartærstruktur
– når flere proteiner danner ett
Et protein trenger ikke alltid være én sammenhengende kjede. Mange av kroppens viktigste proteiner består faktisk av flere polypeptidkjeder, som sammen danner ett fungerende kompleks. Når disse kjedene – kalt subenheter – kommer sammen og samarbeider, kaller vi det kvartærstruktur. Dette er det høyeste nivået av proteinstruktur.
Hver subenhet kan folde seg og fungere for seg selv, men sammen kan de gjøre noe større. De holdes sammen av svake ikke-kovalente krefter, som hydrogenbindinger, ioniske interaksjoner og van der Waals-krefter – og noen ganger av disulfidbindinger, som danner sterke broer mellom subenheter.
Strukturen kan være symmetrisk, med subenheter arrangert som et mønster, eller asymmetrisk, der hver del har sin helt spesifikke rolle.
Kvartærstruktur gjør det mulig å:
- Koordinere funksjon mellom flere enheter
- Regulere aktivitet dynamisk
- Øke effektiviteten i komplekse prosesser
Eksempler du bør kjenne til:
- Hemoglobin: Består av fire subenheter – to alfa- og to beta-kjeder – som samarbeider om å binde og frakte oksygen. Bindingen til én oksygen påvirker de andre.
- Antistoffer (immunoglobuliner): Har fire kjeder i en Y-form – to lette og to tunge. De binder til inntrengere med den ene enden og signaliserer med den andre.
- Pyruvat dehydrogenase-komplekset: Et stort enzymsamarbeid som omdanner pyruvat til acetyl-CoA, en avgjørende overgang mellom glykolyse og sitronsyresyklus. Her finner vi tre ulike enzymaktiviteter samlet i én funksjonell struktur.
Motiver og domener
–Et motiv er et lite, strukturelt mønster i et protein. Det består ofte av noen få alfa-helikser og/eller beta-tråder, arrangert på en bestemt måte som gir en spesifikk funksjon – for eksempel evnen til å binde DNA eller metallioner.
Motiver er ikke selvstendige enheter – de kan ikke fungere alene – men de inngår som funksjonelle komponenter i større strukturer. Samme motiv kan dukke opp i mange ulike proteiner, særlig når disse proteinene har lignende oppgaver.
Man kan sammenligne et protein med en avansert maskin, der motivene utgjør standardiserte deler som kan gjenbrukes – som tannhjul, sensorer eller gripearmer. De er ikke hele maskinen, men avgjørende for at den skal virke.
Eksempler på vanlige motiver:
Zinkfinger (zinc finger): En liten struktur stabilisert av et sinkatom (Zn²⁺), ofte med et karakteristisk foldemønster. Brukes i mange DNA- og RNA-bindende proteiner for å gi nøyaktig kontakt med spesifikke nukleinsyresekvenser.
Helix-turn-helix: Består av to alfa-helikser forbundet med en kort sving (turn). Brukes ofte i DNA-bindende proteiner, som transkripsjonsfaktorer, og gjør det mulig å kjenne igjen spesifikke DNA-sekvenser.
Domener – selvstendige moduler med funksjon
Et domene er en større, strukturell og funksjonell enhet i et protein. I motsetning til motiver kan et domene folde seg selvstendig og ofte fungere uavhengig av resten av proteinet. Mange proteiner består av flere slike domener som samarbeider for å utføre proteinets totale funksjon.
Domener er som moduler i et verktøy – hver med sin oppgave:
- Ett domene kan være ansvarlig for substratbinding
- Et annet for katalytisk aktivitet
- Et tredje for regulering eller signaloverføring
Eksempel: Antistoffets domener
Antistoffer er bygget opp av flere domener som har hver sin oppgave:
- Det antigenbindende domenet fungerer som en spesialisert “hånd” som kan gjenkjenne og binde spesifikke antigener (fremmede molekyler).
- Det konstante domenet virker som en “signalstang” som sender beskjed til resten av immunsystemet om å iverksette en reaksjon.
Disse to domenene fungerer sammen i samme protein og gir det både gjenkjennende og kommuniserende egenskaper.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
Legg igjen en kommentar