Endotelets funksjon
Endotelet er ikke en passiv barriere mellom blod og vev. Det er en intelligent sensorflate, en slags biologisk kommandosentral, som kontinuerlig registrerer trykk, blodstrøm, kjemiske signaler, betennelse og skade. Og det gjør mer enn bare å sanse – det svarer: med å utvide eller trekke sammen blodkar, aktivere eller dempe immunsystemet, forhindre eller fremme blodpropp, og til og med styre om nye blodkar skal vokse frem.
Et sunt endotel holder blodkarene åpne og fleksible, hindrer trombose, demper unødvendig inflammasjon og tilpasser blodtilførselen til vevets behov. Når du trener, tenker, spiser, sover eller blir skadet, tilpasser endotelet seg lynraskt og presist.
Men når endotelet skades – for eksempel ved røyking, diabetes, høyt blodtrykk eller kronisk betennelse – svikter denne finjusteringen. Dette kalles endoteldysfunksjon, og det er en tidlig og viktig årsak til mange av de vanligste karsykdommene: hypertensjon, aterosklerose, hjerneslag og hjerteinfarkt.
Endotelet regulerer:
- Kartonus og blodstrøm – ved å slippe ut signalstoffer som nitrogenoksid (NO), prostacyklin og endotelin.
- Hemostase og trombose – ved å holde blodplatene inaktive i friskt vev, men aktivere dem ved skade.
- Inflammasjon og immunrespons – ved å styre hvilke immunceller som får slippe ut av blodbanen og inn i vevet.
- Angiogenese – ved å avgjøre når og hvor nye blodkar skal dannes.
- Barrierer og permeabilitet – ved å regulere hva som får passere mellom blod og vev.
I tillegg samarbeider endotelet med glatt muskulatur, parenkymceller og sirkulerende blodkomponenter for å sikre optimal sirkulasjon – både lokalt og systemisk.
Målet med denne siden er å gi deg en dyp forståelse av hvordan endotelet regulerer kartonus og blodstrøm, hvordan det samspiller med myogen og metabolsk regulering, og hva som skjer når dette systemet svikter. Vi starter med lokal regulering generelt – og jobber oss deretter inn mot endotelets rolle i detalj.
I små arterier og arterioler – de såkalte motstandskarene – foregår det en kontinuerlig og finstemt regulering av karrenes diameter, som avgjør hvor mye blod som strømmer inn til hvert enkelt vev. Denne reguleringen av karenes sammentrekning og avslapning kalles regulering av kartonus, og den har avgjørende betydning for sirkulasjonsfordelingen i kroppen.
Kartonus påvirker både blodtrykket og lokal blodstrøm. Når glatte muskelceller i åreveggen trekker seg sammen, blir blodkaret smalere og motstanden høyere – noe som reduserer blodtilførselen til det aktuelle vevet. Når muskelcellene slapper av, utvider blodkaret seg, motstanden synker, og mer blod slipper gjennom. Regulering av kartonus er derfor helt nødvendig for å sikre at hvert organ får riktig mengde blod til riktig tid – enten det er i hvile, ved fysisk aktivitet, under fordøyelse, eller ved skade og sykdom.
Denne reguleringen kan styres av sentrale mekanismer, som det autonome nervesystemet og ulike hormoner som sirkulerer i blodet. Men minst like viktig er de lokale mekanismene, som virker direkte i blodåreveggen og det omkringliggende vevet – helt uavhengig av hjernens kommandoer. Disse lokale mekanismene er avgjørende for at kroppen skal kunne tilpasse sirkulasjonen på millisekunder og millimeternivå, for eksempel når en gruppe muskelceller begynner å arbeide eller når et område i hjernen aktiveres.
Lokal regulering av kartonus skjer gjennom tre hovedmekanismer:
- Myogen regulering – en trykkavhengig respons fra selve åreveggen.
- Metabolsk regulering – der lokal kjemi, som O₂ og CO₂-nivåer, styrer blodstrømmen.
- Endotelavhengig regulering – der blodstrømmen og kjemiske signaler påvirker endotelcellene, som igjen kontrollerer glatt muskulatur via signalstoffer.
Disse tre mekanismene finnes i varierende grad i nesten alle organer, men de vektlegges ulikt avhengig av vevets behov. For eksempel er hjernen og hjertet helt avhengige av presis autoregulering og har derfor sterkt utviklet myogen og metabolsk regulering. I huden, derimot, er det sentrale nervesignaler som spiller størst rolle, og lokal regulering er mindre fremtredende i hvile.
De tre mekanismene kan ses som et lokalt kontrollsystem, der blodkaret selv og det omkringliggende vevet samarbeider for å sikre riktig blodstrøm. Samtidig fungerer disse lokale systemene ofte som en finjustering på toppen av sentral regulering – og kan i noen tilfeller overstyre nervesignaler når det virkelig trengs.
For å forstå hvordan kroppen regulerer blodstrømmen på mikronivå, må vi derfor se nærmere på hver av disse mekanismene – én for én – og hvordan de virker, hvor de finnes, og hvilke kliniske konsekvenser det har når de svikter.
Myogen regulering
Myogen regulering er den mest grunnleggende formen for lokal kontroll av kartonus, og bygger utelukkende på egenskaper som ligger innebygd i de glatte muskelcellene i åreveggen selv. Denne typen regulering krever verken nervesignaler eller hormonell stimulering – det er en ren mekanisk respons, drevet av trykkforandringer.
Navnet “myogen” kommer fra det greske ordet myo for muskel og gen for opprinnelse, og betyr altså “muskelstyrt” regulering. Det som skjer, er at glatt muskulatur i arteriolene reagerer direkte på endringer i blodtrykket – ikke på grunn av ytre signaler, men fordi cellene kjenner at de blir strukket. Det er en form for autonom kontraktil respons – altså en respons som oppstår i åreveggen selv, uten at hjernen er involvert.
Når blodtrykket stiger og presser ut karveggen, utløser dette en strekk i de glatte muskelcellene. Dette aktiverer mekanosensitive ionekanaler – særlig kalsiumkanaler – i cellemembranen, og fører til at kalsium strømmer inn i cellen. Økt intracellulært kalsium starter kontraksjonsprosessen, og muskelcellene trekker seg sammen. Resultatet er at blodkaret innsnevres, motstanden øker, og blodstrømmen reduseres – slik at blodstrømmen holdes konstant til tross for det økte trykket. Motsatt, når trykket faller, minsker strekket, muskelcellene slapper av, og blodstrømmen øker igjen.
Dette er altså en form for negativ feedback – der karveggen forsøker å motvirke trykkendringer og holde blodstrømmen stabil. Fenomenet kalles gjerne autoregulasjon, og det finnes særlig i organer hvor stabil perfusjon er kritisk. I disse organene kan blodstrømmen holdes relativt konstant over et bredt spenn av systemisk blodtrykk – typisk mellom 80 og 180 mmHg.
Myogen regulering er viktigst i:
Hjernen
Hjernen er svært følsom for både for høy og for lav blodstrøm. For høy blodstrøm kan gi ødem og økt intrakranielt trykk, mens for lav blodstrøm raskt fører til iskemi og nedsatt bevissthet. Myogen respons i cerebrale arterioler beskytter hjernen mot plutselige trykkøkninger ved å stramme inn blodkarene, og sørger for stabil perfusjon i hele hjernen.
Hjertet
Koronarkarene i hjertet må levere oksygen kontinuerlig til myokard, som aldri har hvilepauser. Under systolen trykkes koronarkarene sammen av hjertemuskelen selv, og myogen respons hjelper med å sikre tilstrekkelig blodtilførsel i diastolen – særlig i subendokardielle områder som er mest utsatt for iskemi.
Nyrer
Nyrene er ekstremt følsomme for trykkendringer, siden filtrasjonen i glomeruli er avhengig av stabilt perfusjonstrykk. Myogen respons i de afferente arteriolene bidrar til å holde det glomerulære filtrasjonstrykket jevnt, og er en del av nyrenes autoreguleringssystem sammen med tubuloglomerulær feedback.
Myogen regulering finnes også i:
Selv om den er sterkest i hjerne, hjerte og nyrer, finnes myogen regulering i varierende grad i de fleste vev, inkludert:
- Skeletmuskulatur
- Hud
- Mage-tarmkanalen
I disse vevene spiller imidlertid andre mekanismer ofte en større rolle, særlig metabolsk regulering og sympatisk kontroll. Her fungerer myogen respons mer som en støtte eller sikkerhetsmekanisme, snarere enn hovedkontrollsystemet.
Klinisk betydning
Myogen autoregulering er en viktig forsvarsmekanisme mot svingninger i blodtrykk. Hvis denne mekanismen svekkes – for eksempel ved hypertensjon, aldring eller endotelskade – blir karene mindre i stand til å kompensere for trykkøkninger. Det kan føre til økt kapillærtrykk, lekkasje av væske og skade på mikrosirkulasjonen. I hjernen kan dette for eksempel bidra til utvikling av lakunære infarkter og mikrovaskulær demens.
Ved høyt blodtrykk over tid vil karene tilpasse seg ved å bli tykkere og stivere, noe som reduserer myogen sensitivitet og kan gi varig skade på organsirkulasjonen. Dette er en viktig del av forklaringen på hvorfor hypertensjon er en stille trussel mot både hjerne, hjerte og nyrer.
Metabolsk regulering
Mens myogen regulering er en ren trykkrefleks fra blodåreveggen selv, handler metabolsk regulering om noe helt annet: vevets behov for oksygen og næringsstoffer. Denne formen for lokal regulering bygger på at blodkarene tilpasser seg den metabolske aktiviteten i vevet – altså hvor mye cellene jobber og hvor mye oksygen de bruker.
Når celler arbeider mer, øker forbrenningen og energibruken. Dette endrer det kjemiske mikromiljøet rundt blodkarene: nivået av karbondioksid (CO₂) stiger, pH faller fordi H⁺-konsentrasjonen øker, oksygennivået synker, ATP-nivåene synker, og adenosin – et nedbrytningsprodukt av ATP – frigjøres. Disse stoffene fungerer som lokale signaler som påvirker glatt muskulatur og endotelceller, og fører til vasodilatasjon. Resultatet er økt blodstrøm akkurat der det trengs, akkurat når det trengs.
Dette er kroppens måte å sørge for at vev med økt energibehov får tilstrekkelig tilførsel av oksygen og glukose, og samtidig blir kvitt avfallsstoffer som CO₂ og laktat. Det hele skjer uten involvering av hjerne, nerver eller hormoner – vevet regulerer sin egen blodtilførsel direkte, basert på sin egen aktivitet.
Viktige signalstoffer i metabolsk regulering
- Adenosin
Når ATP brytes ned under arbeid, frigjøres adenosin. Dette stoffet binder seg til spesifikke reseptorer på karveggen (A₂-reseptorer) og gir kraftig vasodilatasjon – både direkte på glatt muskulatur og indirekte via stimulering av NO-produksjon i endotelet. - Lavt oksygennivå (hypoksi)
Lavt O₂ hemmer kontraksjon av glatt muskulatur og stimulerer produksjon av vasodilaterende faktorer. - Høyt karbondioksid (CO₂) og lav pH (H⁺)
Økt CO₂ fører til lavere pH i vevet, noe som gir vasodilatasjon. Dette virker både direkte på karveggen og via endotelceller. - Ekstracellulært kalium (K⁺)
Ved økt elektrisk aktivitet, som under muskelsammentrekning, lekker K⁺ ut av cellene. Moderat økning i ekstracellulær K⁺ kan hyperpolarisere glatt muskulatur og føre til avslapning og karutvidelse. - Prostaglandiner og NO
Lokalt frigjorte prostaglandiner og nitrogenoksid fra endotelet forsterker vasodilatasjon som respons på metabolsk aktivitet. - Åpning av K⁺-ATP-kanaler
Ved lavt ATP-nivå åpnes spesifikke kaliumkanaler i glatt muskulatur. Dette fører til hyperpolarisering, som gjør cellene mindre tilbøyelige til å trekke seg sammen. Resultatet er lokal vasodilatasjon.
Hvilke vev bruker metabolsk regulering?
Metabolsk regulering er spesielt viktig i vev der oksygenbehovet kan endre seg raskt og dramatisk. Disse vevene er helt avhengige av en presis, lokal blodstrømskontroll:
- Hjerte (myokard):
Hjertet har ekstremt høy og kontinuerlig metabolsk aktivitet. Det lagrer ikke oksygen og er derfor helt avhengig av å få tilført akkurat nok oksygen i sanntid. Metabolsk regulering er den viktigste mekanismen for blodstrømskontroll i hjertet. - Hjerne:
Nevroner har høy forbrenning og er sårbare for selv kortvarig hypoksi. Her skjer en nøye samordning mellom nevronaktivitet og blodtilførsel, kjent som nevrovaskulær kobling. Når en gruppe nevroner aktiveres, øker metabolismen og det lokale miljøet endres – dette fører til vasodilatasjon og økt blodstrøm akkurat der det trengs. - Skjelettmuskulatur under arbeid:
Når musklene begynner å arbeide, stiger oksygenbehovet dramatisk. Lokal produksjon av adenosin, CO₂ og laktat gir vasodilatasjon som matcher blodstrøm til aktivitet. Under hvile er denne reguleringen svak, og andre mekanismer (som sympatisk innervasjon) dominerer.
Metabolsk regulering vs. sentral kontroll
I mange vev – som hud og tarm – er det det autonome nervesystemet som i stor grad styrer blodstrømmen. Her spiller metabolsk regulering en mer beskjeden rolle, i hvert fall i hvile. Men i organer med høy metabolsk fleksibilitet, kan lokale metabolske signaler overstyre sentral regulering. For eksempel kan lokal hypoksi i hjertet oppheve sympatisk vasokonstriksjon – fordi adenosin og NO gir så sterk lokal vasodilatasjon at den overmanner nervesignalet.
Dette gir kroppen en prioriteringsevne: selv når blodtrykket synker, eller kroppen er i stressmodus, får hjertet og hjernen beholde blodtilførselen – takket være lokal metabolsk regulering.
Klinisk betydning
Metabolsk regulering er livsviktig – bokstavelig talt. Uten den ville organer med høy aktivitet raskt utviklet oksygenmangel og celledød. Når denne reguleringen svikter, for eksempel ved endoteldysfunksjon eller iskemisk hjertesykdom, mister kroppen evnen til å forsyne vevet i tide, noe som kan gi symptomer som angina pectoris, svimmelhet, synkope eller tretthet ved anstrengelse.
I forskning bruker man ofte spesielle tester for å måle reaktiv hyperemi – en kraftig, forbigående blodstrømsøkning etter en periode med oksygenmangel – som et mål på metabolsk og endotelavhengig respons. Svekket respons her kan indikere sykdom i mikrosirkulasjonen, selv om de store karene ser normale ut på bildeundersøkelser.
Endotelavhengig regulering
Blodårer er ikke bare rør med glatte muskelceller som reagerer mekanisk på trykk og kjemiske signaler. De er også kledd av et enkelt cellelag – endotelet – som fungerer som en aktiv og intelligent grensesone mellom blod og vev. Dette cellelaget registrerer kontinuerlig blodstrøm, trykk, kjemiske signaler og inflammasjon, og styrer gjennom dette en lang rekke viktige funksjoner – inkludert kartonus.
Endotelet kan både fremme vasodilatasjon og vasokonstriksjon, avhengig av behovet i øyeblikket. Det gjør dette ved å produsere og slippe ut signalstoffer som påvirker glatt muskulatur i karveggen. Denne reguleringen kan være flow-avhengig, altså utløst av endringer i blodstrøm, eller kjemisk, som respons på signalstoffer fra nerver eller vev.
Endotelavhengig regulering er en av de viktigste komponentene i finjusteringen av sirkulasjonen, og er særlig viktig i kar med høyt shear stress – som i hjerte, hjerne og arbeidende muskler.
Flow-mediert vasodilatasjon
Blodstrøm gjennom et kar skaper en mekanisk kraft langs innsiden av karveggen, kalt shear stress. Dette er et mål på friksjonen mellom blodet og endotelcellene. Når shear stress øker – for eksempel ved fysisk aktivitet eller reaktiv hyperemi – tolker endotelcellene dette som et signal på at vevet trenger mer blod.
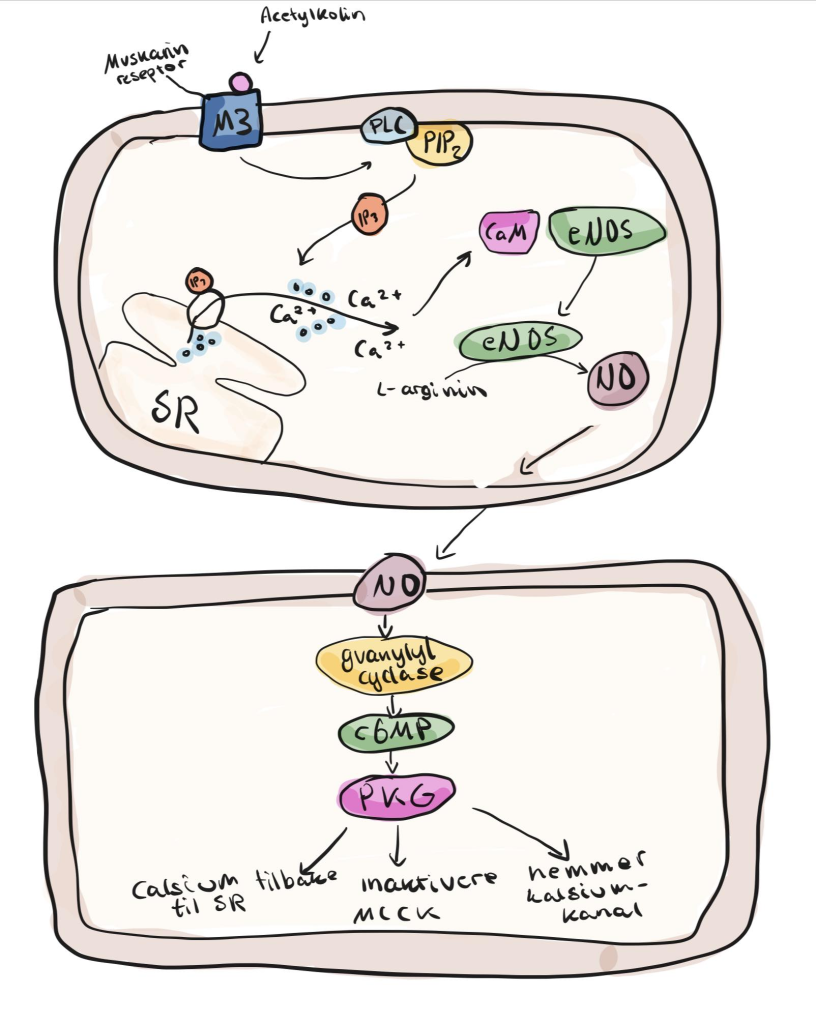
Som respons aktiveres en intracellulær signalkjede i endotelcellene, som fører til produksjon av nitrogenoksid (NO). Dette er kroppens mest potente og presise vasodilator, og den produseres av enzymet eNOS (endotelial NO-syntase) fra aminosyren L-arginin.
NO diffunderer raskt til underliggende glatt muskulatur, der det aktiverer enzymet guanylyl cyclase. Dette øker nivået av cGMP, som igjen aktiverer PKG (proteinkinase G). PKG utløser en rekke intracellulære prosesser som alle har ett mål: å senke kalsiumnivået i muskelcellen. Når kalsium synker, klarer ikke glatt muskulatur å trekke seg sammen – og resultatet er vasodilatasjon.
I tillegg til NO, produserer endotelcellene også:
- Prostacyklin (PGI₂): Som aktiverer cAMP og PKA, og dermed hemmer kontraksjonsmekanismen via MLCK.
- EDHF (endothelium-derived hyperpolarizing factor): Som åpner kaliumkanaler i glatt muskulatur og hyperpolariserer membranen, noe som også fører til avslapning.
Sammen sørger disse tre signalveiene for at blodårene utvider seg når shear stress øker. Dette gjør flow-mediert dilatasjon til en viktig lokal reguleringsmekanisme, spesielt i mikrosirkulasjonen.
Kjemisk regulering
Endotelet reagerer ikke bare på mekanisk stimuli – det tolker også kjemiske signaler fra nervesystemet og det omkringliggende vevet. Et viktig eksempel på dette er hvordan acetylkolin, en nevrotransmitter fra det parasympatiske nervesystemet, påvirker blodkar.
Acetylkolin binder seg til M3-reseptorer på overflaten av endotelcellene. Dette utløser en signalkaskade som øker intracellulært kalsium i endotelcellene, og aktiverer eNOS. Resultatet er økt produksjon av NO og vasodilatasjon – akkurat som ved shear stress.
Det spesielle her er at acetylkolin ikke virker direkte på glatt muskulatur, men på endotelet. Det er altså endotelcellene som medierer avslapningen. Dette gjør det mulig for det autonome nervesystemet å regulere kartonus på en svært finjustert og indirekte måte.
I tillegg til acetylkolin kan også bradykinin, histamin, serotonin og substanser fra immunceller påvirke endotelcellene og stimulere NO-produksjon eller frigjøring av andre vasoaktive stoffer.
Klinisk betydning
Endotelet er helt sentralt i reguleringen av sirkulasjonens balanse. Et sunt endotel gir riktige mengder NO, PGI₂ og EDHF, som sørger for god blodstrøm, lav perifer motstand, lite trombosedannelse og kontrollert immunrespons.
Men når endotelet blir skadet – som ved hypertensjon, røyking, diabetes eller kronisk inflammasjon – reduseres produksjonen av NO, og det som før var et fleksibelt reguleringssystem, blir stivt og ineffektivt. Dette kalles endoteldysfunksjon, og det er en viktig årsaksfaktor i utviklingen av både aterosklerose, hjerteinfarkt, slag og nyresykdom.
Integrasjon mellom systemene
De tre hovedtypene av lokal regulering av kartonus – myogen, metabolsk og endotelavhengig – virker sjelden alene. I virkeligheten er de integrert i et dynamisk samspill, hvor hver mekanisme bidrar på sin måte til å sikre at riktig mengde blod når riktig vev til riktig tid.
Selv om det ofte er hensiktsmessig å beskrive de tre systemene hver for seg, må man forstå at de i praksis er dypt sammenvevd – både funksjonelt og anatomisk.
Samspill i tid og rom
Et godt eksempel er arbeidende skjelettmuskulatur. Når du begynner å løpe, skjer det en rekke ting samtidig:
- Trykkøkning i arteriolene utløser en myogen respons som forsøker å motvirke utvidelse.
- Økt metabolsk aktivitet i muskelcellene gir akkumulering av CO₂, H⁺, adenosin og K⁺, som sterkt stimulerer vasodilatasjon.
- Økt blodstrøm til muskulaturen gir høyere shear stress, som aktiverer endotelet til å produsere NO og PGI₂.
Resultatet blir at den metabolsk betingede vasodilatasjonen og flow-mediert dilatasjon via endotelet overstyrer den myogene kontraksjonen. På denne måten sikres økt blodtilførsel, til tross for at karene i utgangspunktet prøver å stramme seg ved trykkøkning.
I dette eksempelet ser vi at mekanismene ikke motarbeider hverandre, men heller balanserer hverandre. Myogen respons beskytter mot for høy blodstrøm, mens metabolsk og endotelavhengig vasodilatasjon åpner karene der det virkelig trengs.
Samspill mellom vev og kar
De ulike mekanismene aktiveres også fra forskjellige nivåer i vevet:
- Myogen regulering er en egenskap i glatt muskulatur i selve karveggen.
- Metabolsk regulering kommer fra vevets parenkymceller – altså muskelceller, nevroner eller andre celler med høy forbrenning.
- Endotelregulering kommer fra det tynne laget med endotelceller som danner kontaktflaten mellom blod og karvegg.
Det betyr at både karet selv, blodet og vevet rundt er aktive deltakere i blodstrømsregulering. De kommuniserer med hverandre gjennom ioner, metabolitter, trykk og mekanisk friksjon – og til sammen gir de et svært presist og fleksibelt system for blodfordeling.
Klinisk betydning
Forståelsen av dette samspillet er avgjørende i klinikken. Ved sykdommer som hjertesvikt, diabetes og aterosklerose, ser man ofte at én eller flere mekanismer svikter. Hvis endotelet mister evnen til å produsere NO, kan ikke flow-mediert dilatasjon kompensere for lokale behov. Hvis myogen regulering svikter, kan høyt blodtrykk skade kapillærene. Og hvis vevet ikke klarer å signalisere metabolsk behov, kan organer bli underperfundert selv om blodtrykket er normalt.
Ved å teste disse mekanismene – for eksempel med flow-mediert dilatasjon, reaktiv hyperemi eller målinger av rekruttering ved arbeid – kan man identifisere tidlige tegn på mikrovaskulær sykdom før de store årene viser noen skade.
Endoteldysfunksjon
Et sunt og velfungerende endotel er helt avgjørende for normal blodårefunksjon. Det sørger for riktig kartonus, hindrer blodpropp, balanserer immunrespons, og regulerer hvorvidt nye blodkar skal dannes. Men når endotelet blir skadet eller mister evnen til å utføre disse oppgavene, oppstår en tilstand vi kaller endoteldysfunksjon.
Endoteldysfunksjon er ikke en sykdom i seg selv, men en fundamental ubalanse i hvordan blodåreveggen reagerer på stimuli. Det regnes i dag som en tidlig og avgjørende mekanisme i utviklingen av flere alvorlige karsykdommer, inkludert hypertensjon, aterosklerose, hjerteinfarkt og slag.
Kjernen i endoteldysfunksjon: NO-mangel
I hjertet av endoteldysfunksjon ligger som regel én ting: redusert produksjon eller virkning av nitrogenoksid (NO). Dette lille molekylet er en av kroppens viktigste beskyttelsesfaktorer mot karsykdom. NO produseres av enzymet eNOS i endotelcellene, særlig som respons på økt blodstrøm (shear stress) og kjemiske signaler som acetylkolin.
Når NO-produksjonen svikter, skjer det flere uheldige ting samtidig:
- Vasodilatasjon uteblir, og karene forblir sammentrukne, noe som øker blodtrykket og reduserer blodstrømmen til vevet.
- Blodplatene aktiveres lettere, og risikoen for trombose øker.
- Betennelsesprosesser forsterkes, fordi endotelet ikke klarer å holde immuncellene i sjakk.
- Aterosklerotisk plakk kan lettere dannes, og karveggen blir stivere og mer utsatt for skade.
I sum betyr dette at karene mister fleksibiliteten sin, og sirkulasjonen blir dårligere tilpasset kroppens behov – særlig ved belastning, fysisk aktivitet eller stress.
Årsaker til endoteldysfunksjon
Endotelet er følsomt for miljøet rundt seg. Det finnes en rekke kjente risikofaktorer som enten hemmer NO-produksjon direkte, eller fører til oksidativt stress som ødelegger NO før det rekker å virke. Noen av de viktigste er:
- Høyt blodtrykk (for mye strekk og mekanisk stress på karveggen)
- Røyking (nikotin og frie radikaler hemmer eNOS og skader endotelcellene)
- Høyt LDL-kolesterol (oksidert LDL er direkte toksisk for endotelcellene)
- Diabetes og insulinresistens (hyperglykemi og inflammasjon svekker eNOS)
- Kronisk betennelse (lavgradig inflammasjon hemmer NO og øker permeabilitet)
- Alder (eNOS-aktiviteten synker naturlig med alderen)
Felles for disse faktorene er at de skaper et miljø i blodkarene som ikke er vennlig mot endotelcellene – og som gradvis fører til tap av NO-avhengig karbeskyttelse.
Når acetylkolin virker motsatt vei
Et klassisk og talende eksempel på endoteldysfunksjon er hvordan kroppen reagerer på acetylkolin. Under normale forhold stimulerer acetylkolin M3-reseptorer på endotelcellene, noe som fører til økt intracellulært kalsium og NO-produksjon. Dette gir vasodilatasjon.
Men ved endoteldysfunksjon – for eksempel på grunn av aterosklerose – er endotelcellene enten borte eller ute av stand til å produsere NO.
Acetylkolin vil da ikke virke på endotelcellene, men kan i stedet binde seg direkte til M3-reseptorer på glatt muskulatur. Dette utløser en IP₃-mediert kalsiumfrigjøring og gir vasokonstriksjon i stedet for dilatasjon. Det samme signalet, som normalt gir avslapning, gir nå sammentrekning – fordi endotelbarrieren er borte.
Dette fenomenet brukes faktisk i forskning og kliniske studier for å påvise endoteldysfunksjon – og det illustrerer hvor viktig endotelet er som mellomledd i normal karregulering.
Kliniske konsekvenser
Når endotelet slutter å fungere normalt, får det konsekvenser på flere nivåer:
- Hypertensjon: Manglende NO-produksjon fører til økt perifer motstand og høyere blodtrykk.
- Aterosklerose: Økt permeabilitet og aktivering av immunceller gir plakkdannelse.
- Koronar hjertesykdom: Nedsatt vasodilatasjon fører til iskemi og angina, selv uten trange hovedårer.
- Nyresvikt: Mikrosirkulasjonen i glomeruli blir stiv og ineffektiv, noe som reduserer nyrefunksjon over tid.
- Økt tromboserisiko: Endotelet mister sin antitrombotiske rolle, og blodplatene blir lettere aktivert.
Endoteldysfunksjon er dermed en tidlig markør for karsykdom og en viktig forklaring på hvorfor pasienter med normale angiogram kan ha symptomer på hjertesykdom – fordi problemet sitter i mikrosirkulasjonen og endotelet, ikke nødvendigvis i de store hovedårene.
Testing av endotelhelse
Fordi endotelet spiller en så avgjørende rolle i reguleringen av blodstrøm, kartonus og beskyttelse mot sykdom, er det viktig å kunne vurdere hvor godt det fungerer. I motsetning til store arterier, som kan avbildes med ultralyd eller angiografi, er det ikke mulig å «se» endotelcellenes funksjon direkte. Men det finnes metoder som lar oss måle hvordan blodkarene reagerer på fysiologiske stimuli, og dermed indirekte si noe om helsetilstanden til endotelet.
Den mest brukte og anerkjente metoden for dette kalles flow-mediert dilatasjon (FMD). Dette er en enkel, ikke-invasiv test som bygger på kroppens egne prinsipper for karutvidelse, og som gir verdifull informasjon om endotelavhengig regulering.
Hva er flow-mediert dilatasjon (FMD)?
FMD er en test som etterligner det som skjer når en blodåre plutselig utsettes for økt blodstrøm – altså økt shear stress. Under normale forhold vil endotelcellene reagere på denne økningen ved å produsere nitrogenoksid (NO), som gir vasodilatasjon i den aktuelle arterien. Testen går derfor ut på å fremkalle en situasjon med plutselig økt blodstrøm, og deretter måle hvor mye blodåren utvider seg.
Slik gjennomføres testen:
- En blodtrykksmansjett plasseres rundt underarmen og blåses opp til over systolisk trykk. Dette blokkerer blodstrømmen i 5 minutter.
- I løpet av denne tiden bygger det seg opp metabolske vasodilaterende signaler i vevet under mansjetten, mens blodstrømmen reduseres til null.
- Når mansjetten slippes, strømmer blodet plutselig tilbake – et fenomen kjent som reaktiv hyperemi.
- Dette gir en kraftig og plutselig økning i blodstrømmen gjennom overarmsarterien (a. brachialis), og shear stress mot endotelcellene øker dramatisk.
- Et ultralydapparat måler så diameteren på arterien før og etter denne økningen i flow. Et friskt endotel vil gi minst 10 % økning i diameter.
Dersom utvidelsen er svak eller fraværende, tyder det på nedsatt evne til å produsere NO – altså endoteldysfunksjon.
Nitroglyserintest
En viktig oppfølgning til FMD er å teste glatt muskulaturs evne til å reagere på NO direkte. Dette gjøres ved å gi nitroglyserin, en NO-donor som virker uavhengig av endotelet. Dersom karet utvider seg normalt etter nitroglyserin, men ikke ved FMD, vet vi at problemet ligger i endotelcellene, ikke i selve karveggen.
Dersom det derimot ikke skjer noen vasodilatasjon ved nitroglyserin heller, kan problemet ligge i glatt muskulatur eller mer avansert karsykdom.
Konklusjon
Flow-mediert dilatasjon er et elegant eksempel på hvordan man kan måle kroppens egen fysiologi for å vurdere helse. Ved å etterligne et naturlig fenomen – økt blodstrøm – kan man avsløre svikt i endotelets finjusteringsevne. Denne typen tester gir et unikt innblikk i karsystemets funksjonelle tilstand, lenge før strukturelle endringer som plakk, stenoser eller infarkt har oppstått.
Begrepsliste
Adenosin
Et nedbrytningsprodukt av ATP som virker karutvidende ved å aktivere A₂-reseptorer på karveggen.
Acetylkolin (ACh)
Nevrotransmitter fra parasympatiske nerver som binder seg til M3-reseptorer på endotelceller og stimulerer NO-produksjon → vasodilatasjon.
Angiogenese
Prosessen der nye blodkar dannes ut fra eksisterende kar, ofte ved hjelp av vekstfaktorer som VEGF.
Arteriogenese
Utvidelse og remodellering av eksisterende små arterier (kollateraler) til større blodårer, ofte som kompensasjon ved blokkert hovedåre.
ATP (adenosintrifosfat)
Cellens energivaluta. Lavt intracellulært ATP-nivå aktiverer K⁺-kanaler og bidrar til vasodilatasjon.
Bradykinin
Et peptid som stimulerer endotelet til å produsere NO via økt kalsium i cellen.
CAMP / PKA
Signalvei aktivert av prostacyklin som hemmer muskelkontraksjon via redusert MLCK-aktivitet.
cGMP / PKG
Signalvei aktivert av NO i glatt muskulatur som gir redusert kalsium og avslapning → vasodilatasjon.
EDHF (Endothelium-Derived Hyperpolarizing Factor)
Et signalstoff fra endotelet som åpner K⁺-kanaler og hyperpolariserer glatt muskulatur → vasodilatasjon.
eNOS (endotelial NO-syntase)
Enzym i endotelceller som lager NO fra aminosyren L-arginin.
Endotelin-1 (ET-1)
Sterk vasokonstriktor produsert av endotelceller.
Endoteldysfunksjon
Tilstand hvor endotelcellene mister evnen til å regulere karutvidelse og koagulasjon; øker risikoen for hjerte- og karsykdom.
FMD (Flow-Mediert Dilatasjon)
Ultralydmetode for å teste endotelets evne til å reagere på økt blodstrøm ved å produsere NO og utvide blodåren.
Glatt muskulatur (VSMC)
Muskelceller i karveggen som regulerer karlumen ved kontraksjon og avslapning.
Hyperemi (reaktiv)
Økt blodstrøm etter midlertidig okklusjon – brukt i FMD-testing.
ICAM-1, VCAM-1, E-selektin, PECAM-1
Adhesjonsmolekyler på endotelceller som styrer leukocyttmigrasjon under inflammasjon.
K⁺-ATP-kanaler
Kaliumkanaler som åpnes ved lavt ATP → fører til hyperpolarisering og vasodilatasjon.
L-arginin
Aminosyre som fungerer som råmateriale for produksjon av NO i endotelceller.
M3-reseptor (muskarinreseptor type 3)
Reseptor på endotelceller som binder acetylkolin og stimulerer NO-produksjon.
MLCK (Myosin Light Chain Kinase)
Enzym som aktiverer muskelkontraksjon i glatt muskulatur – hemmes av NO og PKA.
Nitroglyserin
Et medikament som virker som NO-donor og brukes for å teste glatt muskulaturs respons på NO.
NO (nitrogenoksid)
Gass og signalmolekyl produsert av endotelet som gir vasodilatasjon og hemmer blodplateaktivering.
PAI-1
Hemmer fibrinolyse – altså oppløsning av blodpropp. Reguleres av endotelceller.
PGI₂ (prostacyklin)
Vasodilator og antitrombotisk faktor produsert av endotelceller. Hemmer plateaktivering.
PI3K-Akt
Signalkaskade i endotelcellen som aktiverer eNOS ved shear stress.
SERCA
Kalsiumpumpe som flytter Ca²⁺ inn i det sarkoplasmatiske retikulum, aktivert av PKG for å redusere kalsium i glatt muskulatur.
Shear stress (skjærkrefter)
Fysisk kraft som oppstår når blod strømmer langs endoteloverflaten. Stimulerer NO-produksjon.
Trombolyse / tPA
tPA (tissue plasminogen activator) løser opp blodpropper. Produseres av endotelceller.
von Willebrand-faktor
Protein produsert av endotelceller som hjelper blodplater å feste seg ved skade.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3